某班同学在做“某些酸、碱、盐之间是否发生反应”的探究实验时发现,酸碱之间的反应,往往没有明显的现象。那么如何判断酸碱发生了化学反应呢?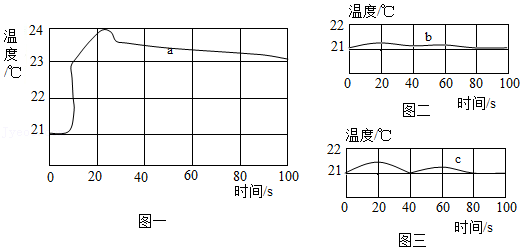
【提出问题】如何判断酸、碱溶液发生了化学反应?
【实验药品】一定质量分数的稀盐酸、一定质量分数的氢氧化钠溶液(稀)、酚酞溶液、蒸馏水。
【实验探究】
(1)甲小组在烧杯中加入50mL氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,发现 (填现象),证明氢氧化钠溶液与稀盐酸发生了化学反应,该反应的化学方程式为 。
(2)乙小组进行了以下三个实验,并用温度传感器测定实验过程中的温度变化情况,得到了如图所示的三条曲线。
实验一:50mL稀盐酸与50mL氢氧化钠溶液混合(曲线a);
实验二:50mL稀盐酸与50mL蒸馏水混合(曲线b);
实验三:50mL氢氧化钠溶液与50mL蒸馏水混合(曲线c)。
结合实验目的分析,增加实验二、实验三的目的是 。
对比三条曲线,可以得到如下结论:
①氢氧化钠溶液和稀盐酸一定发生了化学反应。
②酸碱中和反应是 反应(填“放热”或“吸热”)。
【交流与反思】
(3)甲小组认为,通过实验探究(2)得出“中和反应是放热反应”的结论不严谨,应该补充 实验。
探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
①该实验的目的是_______________、_______________。
两支长颈漏斗中产生的现象的不同之处是_______________。
②若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量_______________(填“多”、“少”或“一样多”)。
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品,加入足量的稀盐酸,搅拌、过滤、洗涤、干燥、称量所得固体质量。
B:称取一定质量的样品,加入一定量的硫酸铜溶液,搅拌、 过滤、洗涤、干燥、称量所得固体质量。
③两种方案,你认为不能达到目的是________(填“A”或“B”),理由是_____________。
④在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数_______________(填“偏大”、“偏小”、“不变”或“无法判断”)。
“辽宁号”航空母舰,是中国人民解放军海军第一艘可以搭载固定翼飞机的航空母舰,制造航空母舰使用大量合金材料(如铁合金、铜合金和钛合金等)。请回答下列问题:
钛(Ti)因其硬度大、熔点高,常温下耐酸碱、耐腐蚀等优良性能而被认为是本世纪的重要金属材料。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如下:
①上述流程中的TiO2中钛元素的化合价是_______________。
②步骤Ⅰ中,钛铁矿中的FeO和碳在高温的条件下反应生成二氧化碳和铁,该反应的化学方程式为_______________ 。
③步骤Ⅱ中,TiO2、炭粉混合物在高温条件下通入氯气(Cl2)制得TiCl4和一种可燃性气体,该气体是_______________。
④步骤Ⅲ反应所得金属钛中含有少量的金属镁。若要除去金属钛中的镁,可选用的试剂是_______________。充分反应后,再通过_______________(填操作名称)、洗涤、干燥即可。
已知A、B、C为氧化物,D为单质,是初中化学常见的物质,B、D中含有地壳中含量第二的金属元素,它们之间转化关系和反应条件如下图:
(1)A和B反应的化学方程式为_______________;
(2)请从微观解释A和C化学性质不同的原因_______________;
(3)请设计简单方法区分B和D:_______________。
某小组同学在学习镁条与盐酸反应会放出大量热的实验后,想研究金属铝与盐酸反应是否也放热,同学们设计了如图所示实验,请你和该小组同学共同完成实验。
(1)将注射器中的稀盐酸加入到锥形瓶内时,可观察到锥形瓶中产生的现象为________;
(2)甲同学观察到反应一段时间后,导管口有气泡冒出的现象,从而得到铝片与稀盐酸反应是放出热量的。乙同学不同意甲的结论,理由是____________________
(3)实验结束后,小组同学发现锥形瓶中的液体的量明显多于加入的稀盐酸,请用理化知识解释锥形瓶液体量增多的原因____________________
水在化学实验中的作用不可忽视。如图所示的四个实验中分别用到水。
请回答:
(1)实验A中水的作用是 ;
(2)实验B中集气瓶中水的主要作用是 ;
(3)实验C中热水的作用是提供热量和 ;
(4)实验D中水的作用是 和 。