“辽宁号”航空母舰,是中国人民解放军海军第一艘可以搭载固定翼飞机的航空母舰,制造航空母舰使用大量合金材料(如铁合金、铜合金和钛合金等)。请回答下列问题:
钛(Ti)因其硬度大、熔点高,常温下耐酸碱、耐腐蚀等优良性能而被认为是本世纪的重要金属材料。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如下:
①上述流程中的TiO2中钛元素的化合价是_______________。
②步骤Ⅰ中,钛铁矿中的FeO和碳在高温的条件下反应生成二氧化碳和铁,该反应的化学方程式为_______________ 。
③步骤Ⅱ中,TiO2、炭粉混合物在高温条件下通入氯气(Cl2)制得TiCl4和一种可燃性气体,该气体是_______________。
④步骤Ⅲ反应所得金属钛中含有少量的金属镁。若要除去金属钛中的镁,可选用的试剂是_______________。充分反应后,再通过_______________(填操作名称)、洗涤、干燥即可。
鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验: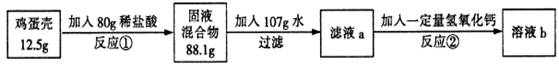
反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应。请回答下列问题:
(1)反应①的化学方程式为___________________________;
(2)根据已知条件列出求解碳酸钙质量(X)的比例式______________;
(3)该鸡蛋壳中碳酸钙的质量分数为_______;
(4)所加氢氧化钙的质量为_______;
(5)溶液b中溶质的质量分数为_______;
(6)用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为_______。
张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究。
【提出问题】Na2CO3属于 (填“酸”、“碱”、“盐”),为什么能使酚酞溶液变红?
【进行猜想】
(1)Na+使酚酞溶液变红。
(2)水分子使酚酞溶液变红。
(3) 使酚酞溶液变红。
【设计实验】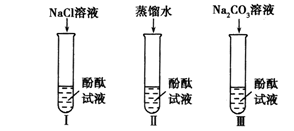
(1)实验Ⅰ的目的是为了验证猜想 不成立。
(2)刘明同学认为实验Ⅱ没必要做,他的理由是 。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红。向变红后的溶液中滴加CaCl2溶液至过量,振荡,出现的现象是 ,反应的化学方程式是 。(提示:CaCl2溶液呈中性)
(4)由实验Ⅰ、Ⅱ、Ⅲ得出猜想(3)正确。张宁对此结论有些质疑,于是他查阅资料。
【查阅资料】Na2CO3溶液中,CO2-3和H2O发生如下反应:CO2-3+H2O=====HCO-3+OH-
【得出结论】Na2CO3溶液中使酚酞溶液变红的粒子是 。
根据下列装置回答问题。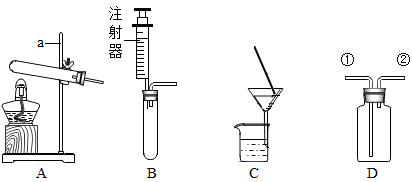
(1)仪器a的名称是 。
(2)C是进行 操作装置中的一部分。
(3)若选用D装置收集CO2,则气体应从 (填“①”或“②”)端进入。若D装置中盛有NaOH溶液,则可以除去CO气体中混有的CO2,反应的化学方程式为 。
(4)向装置A、B中别加入两种试剂都可以制得氧气,两个反应中用到的同一种试剂是 (写化学式),该试剂的作用 (填“相同”或“不同”)。
粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。初步提纯粗盐的实验流程如下: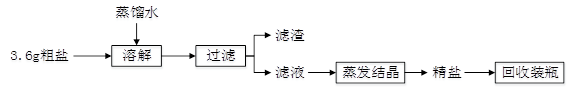
(1)“滤渣”是粗盐中含有的 。
(2)实验过程中四次用到玻璃棒,分别是:
第一次:溶解时搅拌;
第二次: ;
第三次: ;
第四次:将精盐从蒸发皿转移出来。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂的方法而不用降低溶液温度的方法,参考溶解度曲线图分析的原因:
(4)看图可知,200C时NaCl的溶解度为 g,本实验溶解3.6g的粗盐,蒸馏水的最佳使用量约为 ml.增加蒸馏水的用量虽然能加快粗盐的溶解,但会引起的不良后果是 。
在盐酸除铁锈的实验中,我们常会发现生锈的铁钉表面有一些气泡产生,气泡是怎么产生的?针对这一问题,同学们提出了有关假设,并设计了如图甲所示的实验方案惊醒探究,实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的.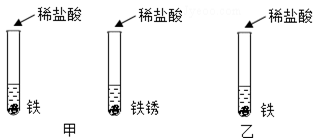
(1)分析上述实验,你认为同学们建立的建设是 .
(2)有同学认为上述实验不够严谨,溶液中的水可能会对实验产生影响.于是他们又进行了对照试验,请你在答题卷的虚线框中用图示的形式将图乙的对照试验补充完整.
(3)还有同学想:气泡会不会是铁锈与水反应产生的?他认为还要补充一个铁锈与水反应的实验,你觉得有没有必要? .