某兴趣小组的同学对二氧化碳的制取和相关性质进行探究。
【气体制取】
(1)实验室用大理石与稀盐酸(1:2)制取二氧化碳的化学方程式为 。
(2)稀盐酸(1:2)是指浓盐酸与水按体积比1:2进行混合所得的盐酸。已知所用浓盐酸中溶质的质量分数为37%,密度为1.19g/cm3;水的密度为1g/cm3。计算所得稀盐酸中溶质的质量分数(计算结果保留一位小数)。
【实验探究】用实验证明碳酸型饮料(如汽水)中含有二氧化碳。
兴趣小组同学用如图所示的装置进行实验:打开汽水瓶盖,立即塞上带导管的橡皮塞,将导管另一端伸入装有试剂的试管中。甲、乙两位同学分别用不同的试剂进行实验。
甲同学在试管中加入少量澄清石灰水,观察到试管内 ,由此得到结论:该汽水中含有二氧化碳。
乙同学在试管中加入少量紫色石蕊溶液,观察到试管内 ,乙同学认为也能得到甲同学的结论。
【评价反思】兴趣小组的同学对甲、乙两位同学的实验方案进行评价。
(1)丙同学认为甲同学的方案比较合理,其试管中发生反应的化学方程式为 。
(2)丁同学质疑乙同学的方案不够严密,认为也可能是该汽水中的柠檬酸随气体进入试管,而引起紫色石蕊溶液的变色。兴趣小组的同学针对丁同学提出的质疑进行了如下探究:
①查阅资料:柠檬酸为无色晶体,易溶于水和酒精;常温稳定,熔点153℃,熔化后沸腾前分解,分解温度约为175℃;柠檬,柑橘等水果中含有柠檬酸。
②乙同学在自己实验的基础上,未增加任何试剂,接着进行了一步实验操作,该操作是 ,可观察到 ,该反应的化学方程式为 。可以确认不是因为柠檬酸而引起紫色石蕊溶液的变色。

某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一瓶溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是溶液。
(2)小刚另取样滴加稀盐酸有产生,小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有产生,设计这一步骤的目的是;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是。
【探究启示】实验取完药品后应。
中和反应在日常生活和工农业生产中有广泛的应用.某化学兴趣小组的同学在老师的指导下对酸碱中和反应进行验证——以硫酸与氢氧化钠溶液是否发生中和反应为例.
[实验药品]稀硫酸、稀氢氧化钠溶液、碳酸钾溶液.
[实验仪器]试管、滴管、10 mL量筒等.
[设计方案并实验]
小江同学的实验:在试管中加入2 mL稀硫酸,逐滴加入溶液,振荡后,再滴入V1 mL溶液,实验过程中无气泡逸出.反应的化学方程式为.
小伟同学的实验:在试管中加入2 mL稀硫酸,逐滴加入氢氧化钠溶液,振荡后,再滴入碳酸钾溶液,有气泡逸出,继续滴加碳酸钾溶液至恰好无气泡时,共消耗碳酸钾溶液V2 mL.
小明同学的判断:小江的实验说明能用碳酸钾溶液来验证;小伟的实验不能说明,需要补做一个实验才能说明.
补做实验并判断:另取一支试管,加入2 mL稀硫酸,
(写出实验步骤、现象和判断依据).
[结论]能用碳酸钾溶液验证硫酸与氢氧化钠溶液发生了中和反应.
[反思]在小江的实验中,碳酸钾溶液的作用是(填字母序号).
A.仅是反应物B.相当于指示剂C.作催化剂
实验室有一瓶长期露置于空气中氢氧化钠溶液,确认已变质。某学习小组展开如下探究,确定该溶液的成分,并进一步制定回收方案。
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分。
【资料1】BaCl2溶液、Ba(NO3)2溶液、CaCl2溶液、Ca(NO3)2溶液、NaNO3溶液均显中性。
| 实验操作 |
实验现象 |
实验结论 |
| Ⅰ.取少量溶液于试管中,向溶液中滴加 (14)溶液,并不断振荡。 |
白色沉淀产生 |
该溶液部分变质,含有 碳酸钠和氢氧化钠。 |
| Ⅱ.将步骤Ⅰ反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液。 |
(15) |
氢氧化钠溶液变质的原因(16)(用化学方程式表示),因此氢氧化钠溶液必须密封保存。
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体。
【探究2】回收纯净的氢氧化钠固体。
【资料2】在不同温度下NaOH的溶解度如下:
| 温度(℃) |
10 |
20 |
40 |
60 |
80 |
100 |
| 溶解度(g/100g水) |
64 |
85 |
138 |
203 |
285 |
376 |

请回答下列问题:
Ⅰ.试剂x的化学式(17),操作y的名称为(18)。
Ⅱ.根据相关物质的溶解度数据,系列操作z中 ② 操作名称为(19)。
Ⅲ.探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,分别是(20)、(21)。
实验室里有一瓶标签残缺的试剂瓶,标签中只剩下“Na”和“10%”字样(如下图所示),某兴趣小组对其组成进行如下探究。
【提出问题】这瓶试剂可能是什么溶液呢?
【查阅资料】
Ⅰ.初中化学中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3,其中一 种物质的类别有别于其它三种物质,该物质是 ⒀。
Ⅱ.NaHCO3的水溶液呈碱性。
Ⅲ.室温(20℃)时,四种物质的溶解度数据如下:
| 物质 |
NaHCO3 |
NaCl |
NaOH |
Na2CO3 |
| 溶解度g/100g水 |
9.6 |
36 |
109 |
215 |
【资料分析】
依据上述资料分析该瓶试剂不可能是碳酸氢钠的原因是 ⒁。
【实验探究】
实验1:
实验测得该溶液的pH>7,则这瓶试剂也不可能是氯化钠。
实验2:
为了检验该溶液是NaOH溶液还是Na2CO3溶液,又进行了如下实验:
取少量溶液于试管中,滴加足量的盐酸,有气泡产生,得出结论,该溶液是Na2CO3溶液。写出上述反应的化学方程式:⒂。有同学对上述结论提出质疑,他认为该溶液可能由 ⒃组成,并设计如下实验。
实验3:
另取样,加入过量的CaCl2溶液(呈中性),观察到有白色沉淀产生,设计这一步骤的目的是 ⒄;静置后,取上层清液,滴入酚酞试液,溶液呈红色;得出结论,该同学的假设成立。
上述实验中,证明所加氯化钙溶液是过量的方法是 ⒅。
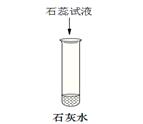
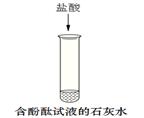
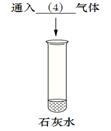
某同学为探究氢氧化钙的性质,进行如下实验。
① 请将实验报告补充完整
| 实验 步骤 |
a |
b |
c |
 |
 |
 |
|
| 现象 |
溶液变为 (1) 色 |
(2) |
有白色沉淀生成 |
| 结论 |
氢氧化钙溶液能与 酸碱指示剂作用 |
反应的化学方程式是(3) 氢氧化钙能与酸反应 |
氢氧化钙能与 (5) (填物质类别)反应 |
② 向试管b反应后的溶液中逐滴滴加Na2CO3溶液,溶液pH的变化如图所示,请回答。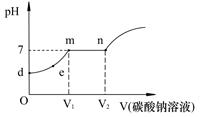
Ⅰ.m点溶液中的溶质是 (6) 。
Ⅱ.滴入Na2CO3溶液的过程中观察到的现象依次是 (7) 。
Ⅲ.随着碳酸钠溶液的加入,下图中错误的是 (8) 。