水是常用溶剂,某同学进行如图实验。

(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,现象是 。
(2)实验可知,溶质状态可以是 。
(3)实验结束后,用洗涤剂洗净B试管,原理是 。
(4)C、D试管的废液倒入废液缸中产生了黄绿色气体,查阅资料可知:2KMnO4+16HCl(浓)═2KCl+2X+5Cl2↑+8H2O,X的化学式为 。
(5)询问老师得知用2NaOH+Cl2═NaCl+NaClO+H2O可处理Cl2。根据化学方程式计算,处理0.142g Cl2至少需NaOH的质量是多少?
向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
(l)合金中锌的质量分数为 。
(2)所用稀盐酸的溶质质量分数。(计算结果保留一位小数)

厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。

计算:该食用碱中碳酸钠的质量分数是多少?(计算结果精确至0.1%)
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题:
(1)葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式氢原子右下角的数字为 ;
(2)若儿童lkg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液 支?

某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2 (Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O)。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3+O2═2Na2SO4;
(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32﹣、SO42﹣均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想1:没有变质,成分是Na2SO3;
猜想2:完全变质,成分是Na2SO4;
你认为还可能有的猜想3 。
【实验探究Ⅰ】甲、乙两组分别进行实验探究溶液是否变质:
|
小组 |
实验操作 |
现象 |
结论 |
|
甲组 |
取少量样品于试管中加入过量稀盐酸; |
产生气泡 |
没有变质,还是Na2SO3 |
|
乙组 |
取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 |
|
已部分变质 |
【评价】有同学质疑甲组方案不合理,理由是 。
【实验探究Ⅱ】
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
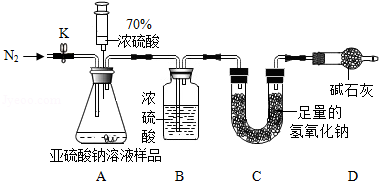
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g
由此,计算出该溶液中Na2SO3的质量分数为 ;
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的 (填“偏小”或“偏大”)。
乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。
第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数。
试完成下列问题:
(1)加入氯化钡溶液过量的目的是 。
(2)第三步操作要洗涤沉淀的原因是 。
【反思】由此可得出,保存亚硫酸钠时应 。
工业上从海水中提取出MgCl2、KCl两种物质的混合物,为了测定其中KCl的质量分数,现进行如下测定:取混合物样品19g,向其中加入100g水,完全溶解后,滴加KOH溶液,生成沉淀的质量与加入KOH溶液的质量关系如图所示。
请计算:
(1)混合物样品中KCl的质量分数。
(2)当恰好完全反应时,所得溶液中溶质的质量分数。
