短 周期元素 W 、 X 、 Y 和 Z 在 周期表中的相对位置如 表 所示,这四种元素原子的最外层电子数之和为 21 。 下 列 关系正确 的 是( )
| A. |
氢化物沸点: |
B. |
氧化物对应水化物的酸性: |
| C. |
化合物熔点: · |
D. |
简单离子的半径: |
下列关于有机化合物的叙述不正确的是()
| A.新制的氢氧化铜可以检验病人是否患有糖尿病 |
| B.三氯甲烷可以做麻醉剂,它和四氯化碳都是重要的有机溶剂 |
| C.根据金属钠与水、乙醇、乙酸反应剧烈程度的不同,可以说明分子中羟基上氢原子的活泼性不同 |
| D.植物油不能使溴的四氯化碳溶液褪色 |
下列说法不正确的是()
| A.麦芽糖及其水解产物均能发生银镜反应 |
| B.用溴水即可鉴别2,4-己二烯和甲苯 |
| C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
D.用甘氨酸(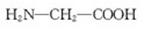 )和丙氨酸( )和丙氨酸(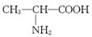 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
丙烯醇(CH2=CH—CH2OH)可发生的化学反应有()
①加成②氧化③酯化④加聚⑤取代
| A.只有①②③ | B.只有①②③④ | C.①②③④⑤ | D.只有①③④ |
2011年3月15日,CCTV-1在3·15特别行动节目中,曝光了双汇在食品生产中使用“瘦肉精”猪肉,一时间市场哗然。“瘦肉精”又称克伦特罗,其结构简式如右图。下列有关“瘦肉精”的说法不正确的是()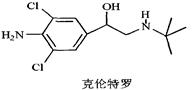
| A.它的分子式为C12H18N2Cl2O |
| B.它含有氨基、氯原子、羟基等官能团 |
| C.1mol克伦特罗最多能和3 molH2发生加成反应 |
| D.一定条件下它能发生水解反应、消去反应、氧化反应、加聚反应等 |
分子组成为C4H10O的饱和一元醇中,可以催化氧化生成醛的有()
| A.1种 | B.2种 | C.3种 | D.4种 |