化合物 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
| A. |
元素电负性: |
B. |
氢化物沸点: |
| C. |
第一电离能: |
D. |
和 的空间结构均为三角锥形 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.原子半径按X、Y、Z、R、W的顺序依次增大 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.Z与Y形成的化合物可作为耐高温材料 |
| D.热稳定性:X2R >X2Y |
氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;CuH跟盐酸反应能产生气体。以下有关推断中不正确的是
| A.“另一种反应物”在反应中表现还原性 |
| B.CuH在化学反应中既可做氧化剂也可做还原剂 |
| C.CuH在氯气中燃烧的化学方程式为CuH+Cl2==CuCl+HCl |
| D.CuH与盐酸反应生成的气体是H2 |
下列正确的叙述有
① CO2、NO2、P2O5均为酸性氧化物
② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦体积相同、pH相同的盐酸和醋酸溶液分别与锌粒反应,醋酸生成的氢气较多
⑧金属元素和非金属元素形成的化合物一定是离子化合物
| A.2个 | B.3个 | C.4个 | D.5个 |
反应:①PCl5(g) PCl3(g)+Cl2(g) ②2HI(g)
PCl3(g)+Cl2(g) ②2HI(g) H2(g)+I2(g) ③2NO2(g)
H2(g)+I2(g) ③2NO2(g) N2O4(g)
N2O4(g)
在一定条件下,达到化学平衡时,反应物的转化率均是 a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.①增大,②不变,③减少 |
| C.均增大 | D.①减少,②不变,③增大 |
离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3-的摩尔电导率分别为0.60、1.98、0.45,据此可判断,往饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是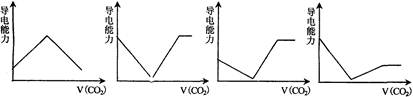
A. B.C. D.