人体呼出气体中主要含有氮气、氧气、水蒸气、二氧化碳。为验证人体呼出气体的成分,某兴趣小组利用下面装置进行实验。

请回答:
①呼出气体通过装置A可观察到 ,目的是 ;
②随反应进行,装置中铜网逐渐变为黑色,其反应的化学方程式为 ;
③装置D出现白色浑浊,证明呼出的气体中含有 ;
④E装置的作用是 ,尾气的主要成分是 。
我市某校化学兴趣小组利用图装置进行“硫燃烧现象及酸雨危害模拟”实验,
(1)按图装置连接仪器,装好药品,塞紧胶塞;
(2)用放大镜聚强光引燃硫粉,可观察到硫粉燃烧时发出明亮的 色火焰
(3)冷却后,用注射器向广口瓶中喷水,可观察到:
①绿叶变黄 ②小烧杯里收集到一定量的液体; ③氧化铜粉末逐渐消失,溶液变成蓝色。
(4)取出小烧杯里收集到的液体进行检验,结果该溶液为酸性(样品)
【提出问题】小烧杯里刚收集到的样品中溶质是什么?
【查阅资料】①SO2易溶于水,化学性质与二氧化碳有相似之处;②H2SO3易被氧化物为H2SO4;
③BaSO3不溶于水,能与盐酸反应;BaSO4既不溶于水,也不溶于盐酸。
【作出猜想】
猜想Ⅰ:样品中溶质含有H2SO3;猜想Ⅱ:样品中溶质含有H2SO4;猜想Ⅲ:样品中溶质含有 (填化学式)
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
向刚收集到的样品中滴加过量的Ba(OH)2溶液,过滤 |
有白色沉淀生成 |
猜想 正确 |
|
向白色沉淀中加入足量的 |
沉淀不溶解 |
【交流讨论】
(1)向刚收集到的样品中滴加过量的Ba(OH)2溶液的目的是
(2)酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
【拓展延伸】
SO2气体可用氢氧化钠溶液吸收,反应原理是 (用化学方程式表示)

一些金属易生锈,某小组同学设计如下实验,对金属锈蚀进行探究.
【实验一】取5枚去油去锈的洁净铁钉,分别装入下表的试管中,进行实验.
|
实验图示 |
|
|
|
|
|
|
生锈时间 |
8min |
较长时间不生锈 |
5min |
3min |
1min |
(1)通过上述实验可知,温度越高铁钉生锈速率越 (填“慢”或“快”);在 (填“酸性”、“碱性”或“中性”)环境中铁钉生锈速率较快.
【实验二】为探究铁锈的成分,用图1所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全).
【查阅资料】无水硫酸铜能吸收水而变蓝,碱石灰既能吸收水也能吸收CO2.
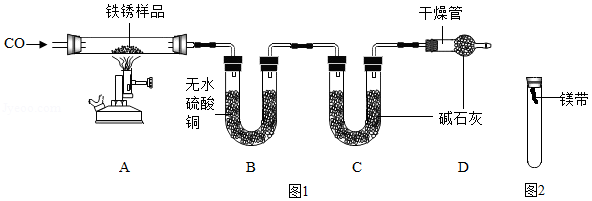
(2)请指出图1所示实验装置的一个明显缺陷: .
(3)加热前,先通入CO一段时间,目的是 .
(4)将铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝, 由此推知铁锈中一定含有 元素,从而推断出空气中的 参加了铁生锈反应.
【实验记录】
|
铁锈样品的质量/g |
装置B的质量/g |
装置C的质量/g |
|
|
反应前 |
23.2 |
232.4 |
198.2 |
|
反应后 |
/ |
239.6 |
211.4 |
(5)根据上表数据推算,可确定铁锈的成分,用FexOy•nH2O表示,则n= ;若缺少D装置,x:y的值 (填“偏大”、“偏小”或“无影响”).
(6)欲通过实验探究镁带在空气中锈蚀的条件,用图2所示装置,试管内可选用的物质如下:
①O2②水③CO2④O2和CO2⑤CO2和水⑥O2和水⑦O2、CO2和水
至少需要选用 (填数字序号),才能达到探究镁带锈蚀的条件.
(7)请写出镁带在空气中锈蚀,生成碱式碳酸镁[Mg3(OH)2(CO3)2]的化学方程式 .
分析如图,回答问题。

(1)实验室用二氧化锰和氯酸钾制取氧气时,发生装置可以选用图1中装置 (填字母序号),二氧化锰作该反应的 。
(2)用图2的装置进行铁丝在O2中燃烧的实验,容易导致集气瓶炸裂,为了避免这种情况,应采取的措施是 。
(3)如图3所示,红磷用酒精灯加热后才能燃烧,由此可知可燃物燃烧的条件之一是 ;红磷燃烧后冷却至室温,活塞a停在刻度 (填数字)处。
某化学兴趣小组学习碱的性质后,到实验室做实验。小明将二氧化碳通入氢氧化钠溶液后无明显现象,然后向得到的溶液中滴加CaCl 2溶液,产生白色沉淀;小杰做的实验和小明一样,但没有出现白色沉淀。他们为了查明原因,查阅资料:①CO 2与NaOH反应的产物与反应物的量有关,少量CO 2得到Na 2CO 3,过量CO 2得到NaHCO 3,反应的化学方程式:CO 2+2NaOH=Na 2CO 3+H 2O,Na 2CO 3+CO 2+H 2O=2NaHCO 3;②Ca(HCO 3) 2溶于水,溶液呈碱性;③CaCl 2溶液呈中性:④Na 2CO 3、NaHCO 3溶液都呈碱性,都能与酸反应;⑤铝、锌、铁、铜的盐溶液与NaHCO 3溶液混合会产生沉淀。
他们对CO 2与NaOH溶液反应后,溶液中溶质是什么进行探究。
【猜想与假设】猜想①Na 2CO 3;猜想②NaHCO 3;猜想③Na 2CO 3、NaOH;猜想④ 。
【实验探究】
|
实验操作 |
实验现象 |
结论 |
|
(1)取适量反应后的溶液于试管中,加入适量的CaCl 2溶液,振荡;再加入 |
无明显现象;有气泡产生。 |
猜想②成立,反应的化学方程式 。 |
|
(2)取适量反应后的溶液于试管中,加入过量的CaCl 2溶液,振荡;过滤,取滤液于另一支试管中,滴加 。 |
产生白色沉淀; 。 |
猜想③成立 |
【继续探究】将4.0gNaOH固体溶解在100mL水中,然后通入4.0g二氧化碳气体,充分反应后,所得溶液的溶质是 。
实验室部分仪器或装置如图所示,请回答下列问题.

(1)写出仪器名称:A 、B .
(2)实验室常用石灰石和稀盐酸制取二氧化碳气体,发生装置可选择图中的 (填字母)进行组装,反应的化学方程式为 .
(3)在制取过程中,小雨同学选用F装置收集二氧化碳,并用燃着的小木条放在瓶口验证二氧化碳是否收集满,发现小木条始终不熄灭,说明该瓶气体没有集满.出现上述现象的原因可能是(写一个): .
(4)在实验室中制取氧气,若用如图H所示装置采用“排空气法”收集氧气,请在图中将导管补画完整.