氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。
液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是____ (填写选项序号)。a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。
双通玻璃管的作用: ;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如图,①②③分别代表以上三组实验测得的数据曲线。
(2)请根据实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
(3)实验①、②表明温度升高,该降解反应速率_____。 (增大或减小)但其他文献表明,温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_________________________。
(4)实验③得出的结论是:pH等于10时, __
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。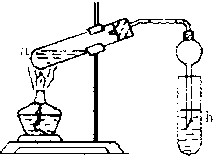
(3)浓硫酸的作用是:①;② 。
(4)饱和碳酸钠溶液的主要作用是。
(5)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: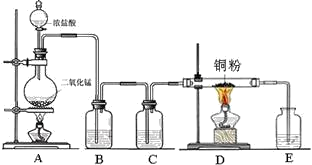
(1)写出烧瓶中发生反应的化学方程式,。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
(本小题满分7分)某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题: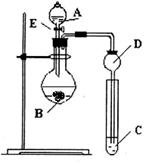
(1)图中D装置名称是。
(2) N、C、Si的非金属性由强到弱的顺序是:;
从以下所给物质中选出甲同学设计的实验所用到物质:
试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
(3) 乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。
(14分)某研究性学习小组将一定浓度的Na2 CO3 溶液滴入CuSO4 溶液中得到蓝色沉淀。甲同学认为两者反应只生成一种沉淀CuCO3 ;乙同学认为两者相互促进水解,只生成一种沉淀Cu(OH)2 ;丙同学认为生成CuCO3 和Cu(OH)2两种沉淀。[查阅资料知:CuCO3 和Cu(OH)2 均不带结晶水]
Ⅰ.按照乙同学的理解,Na2 CO3 溶液和CuSO4 溶液反应的化学方程式为。
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作①过滤、②洗涤、③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为。
(2)装置C中所装试剂的名称是。
(3)能证明生成物中有CuCO3 的实验现象是。
Ⅲ.若CuCO3 和Cu(OH)2两者都有,可通过下列所示装置进行定量分析来测定其组成。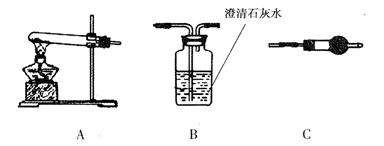
(1)装置C中碱石灰的作用是,实验开始和实验结束时都要通入过量的空气,其实验结束时通入空气的作用是。
(2)若沉淀样品的质量为m g,装置B的质量增加了n g,则沉淀中CuCO3的质量分数为。