铜是一种常用的金属,纯净的铜颜色为紫红色,它能够和硝酸银溶液发生化学反应,生成硝酸铜和银单质。某同学设计下表所示实验,探究金属铜对过氧化氢溶液分解速率的影响。
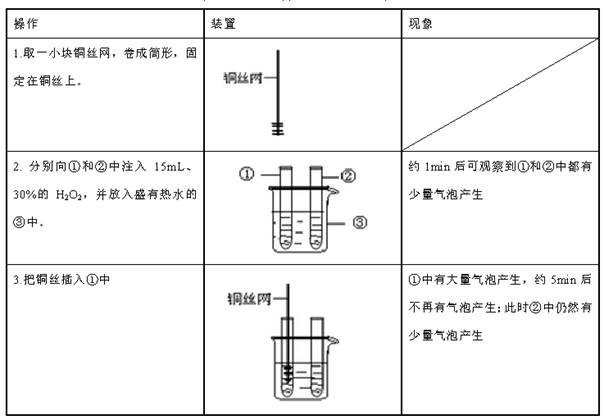
(1)仪器②中实验的目的是__________________;
(2)根据上述实验,可以得出的结论是 ;
(3)如果用本实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是 。
| A.称量实验前铜丝网的质量 | B.将实验后的铜丝网干燥、称重 |
| C.向仪器中加入二氧化锰 | D.将实验后的铜丝网插入AgNO3 溶液中 |
(8分)小丽实验操作模拟考试匠考题是:用碳酸钠溶液鉴别稀盐酸食盐水和澄清石灰水。
| 搡作步骤 |
实验现象 |
实验结论 |
| 分别用A、B、C三支试管取样,然后各加入适量碳酸钠溶液 |
A中无明显现象 B中 C中 |
A中物质是食盐水 B中物质是浠盐酸 C中物质是澄清石灰水 |
【进行实验】
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案。
【实验与探究】
(1)小丽将所有废液倒入一洁净烧杯中,静置后得到上层清液:
(2)取少量清液加入跑题的氯化钙溶液(中性),再滴加几滴无色酚酞试液,若出现的现象,说明上层清液中一定有碳酸钠和氢氧化钠,一定没有。(填离子符号)
【方法与应用】通过以上探究,处理上述废液的正确方法是。
造成酸雨的主要物质是二氧化硫(
),某兴趣小组的同学收集某地刚降到地面的雨水进行实验.
【相关信息】①用
计(测
的仪器)每隔几分钟测一次
,其数据如下表所示:
| 测定时间 |
5:05 |
5:10 |
5:15 |
5:20 |
5:25 |
5:30 |
5:35 |
| 4.95 |
4.94 |
4.94 |
4.88 |
4.86 |
4.85 |
4.85 |
③
不溶于水,但能跟稀盐酸反应,
既不溶于水,也不与稀盐酸反应
【分析讨论】①酸雨能使土壤酸化,农业上常用中和酸性土壤.
②酸雨能腐蚀金属制品,请写出一种防止室外金属被腐蚀的方法.
③收集的酸雨样品放置一段时间后
减小,原因是
与
反应生成
被氧化为
,请写出
被氧化生成
的化学方程式.
【提出猜想】同学们对收集到的酸雨样品的溶质进行猜想:
猜想I:酸雨中溶质为
.
猜想II:酸雨中溶质为
猜想III:酸雨中溶质为.
【实验探究】向收集的酸雨样品中滴加过量的
溶液,有白色沉淀生成,过滤,向沉淀中加入足量的稀盐酸,请完成下表:
| 现象 |
结论 |
| ①如果沉淀没有溶解 |
则猜想正确 |
| ②如果沉淀全部溶解,并放出有刺激性气味的气体 |
则猜想正确 |
| ③如果 | 则猜想III正确 |
【拓展延伸】酸雨中含有的酸除了上面的 和 以及空气中 与 反应生成的 外,还可能含有的酸根是.
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是.
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取样于试管中,滴加稀盐酸 |
有生成 |
原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 |
溶液成红色 |
原溶液一定有 |
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是(用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是.
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
(1)贝壳高温煅烧时,发生反应的化学方程式是;
(2)操作Ⅰ中用到的玻璃仪器有烧杯、、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的
乙:
和
的混合物
丙:
和
的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 |
现象 |
结论 |
|
| 甲 |
取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 |
溶液变红 |
猜想成立 |
| 乙 |
取少量固体C,溶于适量水形成溶液后,滴加足量 | 无气泡产生 |
猜想不成立 |
| 丙 |
取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液 |
猜想成立 |
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
[查阅资料]
| 名称 |
食用纯碱 |
食用小苏打 |
| 主要成分 |
|
|
| 酸碱性 |
水溶液显碱性 |
水溶液显碱性 |
| 热稳定性 |
受热不分解 |
270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变色,但食用纯碱溶液中颜色更深,由此推测可能溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用进行测定.
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到(填"甲"或"乙")烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为,装置中棉花的作用是.
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.
数据记录如下:
| 称量项目 |
称量时间 |
质量/g |
| 试样 |
11.0 |
|
| 装置+稀盐酸 |
160.0 |
|
| 装置+稀盐酸+试样 |
反应开始后20s |
167.0 |
| 装置+稀盐酸+试样 |
反应开始后30s |
166.6 |
| 装置+稀盐酸+试样 |
反应开始后90s |
166.6 |
②通过计算确定食用纯碱粉末中
的质量分数.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是.(答一种即可)