化学兴趣小组的同学在验证硫酸的性质时,进行了以下实验。

【实验一】浓硫酸稀释过程中的能量变化。
图一实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水 。
【实验二】溶液浓度对硫酸化学性质的影响。
图二实验中,观察到很快变黑的是滤纸 (填“A”或“B”),由此可知,硫酸溶液的浓度不同,腐蚀性不同。
【实验三】稀硫酸的化学性质。
小组同学按图三进行实验。
(1)试管1中发生反应的化学方程式为 。
(2)试管2中可观察到的现象是 。
(3)向试管3中滴加了足量的稀硫酸仍无明显现象,要证明二者已经发生反应,可选用
(填字母序号)继续进行实验,以达到实验目的。
A.酚酞溶液
B.氯化钡溶液
C.硫酸铜溶液
(4)小组同学将4、5两支试管反应后的物质倒入同一洁净的烧杯中,充分反应后过滤,得到无色滤液和白色沉淀。同学们对白色沉淀的成分产生了兴趣,继续进行实验。
【提出问题】白色沉淀的成分是什么?
【作出猜想】猜想一:
猜想二:BaSO4、BaCO3
【实验与结论】
实验操作 |
实验现象 |
实验结论 |
取少量白色沉淀与试管中,向其中加入足量的稀盐酸。 |
。 |
猜想二成立。 |
实验结束后,在老师指导下同学们对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,向该废液中加入适量的
(填一种具体物质),处理后再排放。
某气体由H2、CO中的一种或两种组成,某学校化学兴趣小组对该气体的组成
进行探究。
【猜想】① 气体中只有H2;② 气体中只有CO;③ 气体中既有H2,又有CO.
【查阅资料】白色无水硫酸铜遇水会变蓝色。
【实验设计】通过上述资料和已有化学知识,设计了以下装置进行实验。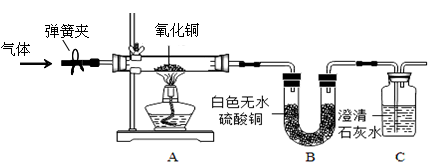
根据以上设计,请完成填空:
(1)若无水硫酸铜变蓝色,石灰水不变浑浊,则猜想①正确。
(2)若无水硫酸铜,石灰水 ,则猜想②正确。
(3)若无水硫酸铜,石灰水 ,则猜想③正确。
【实验步骤】
①打开弹簧夹,先通一会儿气体;②关闭弹簧夹,点燃酒精灯加热。
【实验结论】
通过对实验现象进行分析,确认猜想③正确。
实验过程中,玻璃管中的现象是;
请写出装置C中发生反应的化学方程式。
【反思与评价】
(1)该实验开始通一会儿气体的目的是。
(2)从环保的角度分析该实验装置的不完善之处是。
(3)该实验装置中,若将装置B、装置C对调,将(填“能”或“不能”)得到正确结论,原因是。
(8分)小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【作出猜想】
猜想一:Cr>Fe>Cu;猜想二:Fe>Cu>Cr;猜想三:你的猜想是。
【查阅资料】
铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮,分别放入等量的同种稀硫酸。
【结论与解释】
(1)小聪得到的结论是猜想正确。
(2)实验前用砂纸打磨金属片的目的是。
【知识运用】
将铬片投入FeSO4溶液中,反应(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式。
早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空: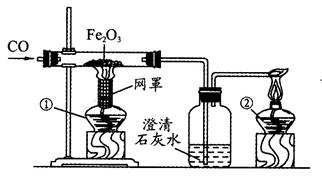
(1)写出CO还原Fe2O3的化学方程式;
(2)实验中盛澄清石灰水的试管中可观察到的现象是;
(3)右边导气管口放置点燃的酒精灯的目的是;实验时,应先点燃第个酒精灯。
(4)某同学用此图进行实验,开始时玻璃管中产生了黑色粉末,但过了一会儿,黑色粉末又变为了红色。出现这种现象的原因
某校研究性学习小组在做“寻找新的催化剂”课题时,发现将生锈的铁钉放到过氧化氢溶液中,也可以加快过氧化氢的分解速率.于是,他们对此展开探究:
【提出问题】生锈的铁钉中,哪种物质能做H2O2分解的催化剂?与二氧化锰相比哪种物质更适合H2O2做分解的催化剂?
【提出猜想】猜想一:林菲同学:铁钉表面的Fe2O3是H202溶液分解反应的催化剂。
猜想二:小华同学:铁钉中的铁是H202分解的催化剂。
| 实验编号 |
操作步骤 |
实验现象 |
| 实验1 |
将带火星的木条伸入盛有10mL 5%的H2O2溶液的试管内,观察现象 |
木条不复燃 |
| 实验2 |
在盛有1克Fe2O3固体的试管中加入10mL5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. |
有大量气泡产生,带火星的木条复燃 |
| 实验3 |
在盛有1克_____的试管中加入10mL 5%的H2O2溶液,再将带火星的木条伸入试管内,观察现象. |
木条不复燃 |
【分析与结论】
(1)设计“实验1”的目的是_____。
(2)由上述实验可知,猜想____错误。实验(2)反应的化学方程式为_____
(3)同学们讨论后认为,林菲同学的“实验2”还不能够确切的证明氧化铁就是过氧化氢分解制取氧
气的催化剂,理由是:_____。
(4)小华通过仔细观察发现“实验3”中一直没有变化的试管,过了一段时间后试管中也出现了气体,小华觉得很奇怪,你能猜想其中的原因吗?( 如果你能正确回答下列问题,你将得到4分奖励,但本卷总分不超过60分)
(5)请设计实验探究Fe2O3和MnO2,哪种物质更适合做H2O2分解的催化剂?__________
某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的化学方程式:。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端 管口点燃,也有火焰产生(如图所示)。
由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 |
熔点╱℃ |
沸点╱℃ |
燃烧时温度╱℃ |
| 石蜡 |
50∽70 |
300∽550 |
约600 |
| 铁 |
1535 |
2750 |
约1800 |
| 钠 |
97.8 |
883 |
约1400 |
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(4)木炭在氧气中燃烧没有火焰,其原因可能是。