有人设计一个Na2O2与CO2反应实验装置图如下:
打开止水夹,发现CO2通过裹有Na2O2的脱脂棉,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2与CO2反应的结论是:
a:有氧气生成:b:
(2)甲、乙两位同学各称取质量为m g的过氧化钠与二氧化碳反应后的样品,并用下图所示仪器测定样品的组分。
请回答下列问题:
①甲同学通过实验测得的数据是氧气的体积,该同学读取实验数据时应注意冷却至室温、____________、眼睛视线与凹液面最低处相切。
②乙同学通过连接仪器①②进行实验,他测得的数据是 。按他测得的数据计算出的实验结果偏高,理由是 。
③为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序 。
④按③设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1 g和w2 g,则样品中碳酸钠的质量分数为 。
⑤在③的改进装置中由于受到仪器的局限,是否也有不足之处 (若没有,此空不必回答;若有,请一并说出不足的理由) 。
[化学]三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为__ _,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg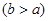 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。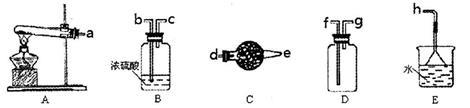
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接_________,_________接_________,_________接h;用A装置制取NH3的化学反应方程式为
(2)用右图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用_________(选填字母编号);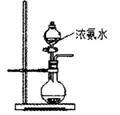
A碱石灰B生石灰
C无水氯化钙D无水硫酸铜
E烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是_____________,试写出制纳米级碳酸钙的化学方程式__________________;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 。
锰及化合物在现代工业及有极其重要的用途。
(1)MnO2是一种重要的无机功能材料,蕴藏在海底的丰富的锰结核矿的主要成分是MnO2,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: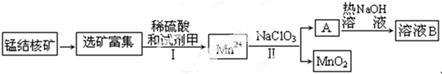
为提高硫酸淋洗效果,需要对富集后的矿石进行处理,处理的内容是_____________,步骤I中,试剂甲必须具有的性质是 。
a.氧化性 b.还原性 c.酸性
(2)步骤Ⅱ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为__________________________。已知溶液B中的产物之一(Q)可循环用于上述生产,试写出A与NaOH反应的化学方程式_______________________,由于Q可循环利用,有人认为生产中不需要补充物质Q,你是否同意这种看法,理由是_______________。
(3)电解步骤I所得溶液也可得到MnO2,写出生成MnO2的电极反应_______________。
(12分)某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率。
饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%
甲方案:利用甲、乙装置测定饱和食盐水的电解率,
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的实验现象:__________________
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为 连_______(填A、B、C、等导管口),则洗气瓶a中发生反应的离子方程式为___________________
乙方案:利用甲、丙装置测定饱和食盐水的电解率,
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率,
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①.一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与 口连接
a.A b.Bc.Dd.E
②.另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?请说明理由
丙方案:只利用甲装置测定饱和食盐水的电解率。
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率
(假设电解前后溶液体积不变,饱和食盐水密度约为1.33 g/mL,溶解度为36.0g)。
超氧化钾(KO2)又称为化学氧自救剂,容易与空气中的水、二氧化碳等发生反应,主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。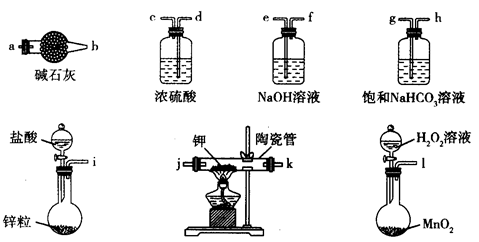
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为____________________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:
根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:____________________________________。与过氧化钠相比,其优点是____________________________________。