右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是 ( )

A.该试剂的物质的量浓度为9.2 mol·L-1 |
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L |
C.配制200 mL 4.6 mol·L—1的稀硫酸需取该硫酸50 mL |
D.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
| A.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 |
| B.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 |
C.C(s)+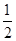 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 |
| D.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是()
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
有一种铁的“氧化物”样品,用5mol/L盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是( )
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是( )
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+3H++NO3—=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
某溶液中有银离子、镁离子、亚铁离子和铝离子,若向其中通入过量的氨气,水浴加热后并搅拌后过滤出沉淀,再向沉淀中加入足量的盐酸,则所得新溶液中数目大量减少且在上述条件下能形成沉淀的阳离子是( )
| A.银离子 | B.亚铁离子 | C.镁离子 | D.铝离子 |