将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
| A.9:1 | B.10:1 | C.1l:1 | D.12:l |
可逆反应2NO2 2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变
| A.①③⑤ | B.①④⑤ | C.①③④⑤ | D.①②③④⑤ |
下列热化学方程式正确的是
| A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa 下,将0.5 mol N2和 1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
| C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为 H2(g)+ 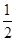 O2(g) O2(g)  H2O(g)ΔH=-242 kJ/mol H2O(g)ΔH=-242 kJ/mol |
| D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ/mol |
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
| A.NH4Cl=NH3↑+ HCl↑ | B.NH3+CO2+H2O=NH4HCO3 |
| C.2NaOH+Cl2=NaCl+NaClO+H2O | D.2Na2O2+2CO2=2Na2CO3+O2 |
下列关于化学反应限度的说法中正确的是
| A.改变外界条件不能改变化学反应的限度 |
| B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态 |
| C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度 |
| D.当某反应达到限度时,反应物和生成物的浓度一定相等 |
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A.该反应的化学方程式为3B+4D 6A+2C 6A+2C |
B.反应进行到1 s时, = = |
| C.反应进行到6s时,B的平均反应速率为0.05 mol/(L·s) |
| D.反应进行到6s时,各物质的反应速率相等 |