常温常压下,用电火花引爆H2和Cl2所组成的混合气体,反应停止后再恢复到原来的温度和压强,测得气体体积与发生反应前恰好相等.则下列叙述合理的是
| A.与原混合气体中H2和Cl2的体积配比无关 |
| B.原混合气体中H2的体积一定大于Cl2的体积 |
| C.原混合气体中H2的体积一定小于Cl2的体积 |
| D.原混合气体中H2的体积恰好与Cl2的体积相等 |
甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
| A.a的浓度必小于乙酸的浓度 | B.a的浓度必大于乙酸的浓度 |
| C.b的浓度必小于乙酸的浓度 | D.b的浓度与乙酸的浓度无法比较 |
右图中的曲线是表示其他条件一定时,2NO+O2 2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )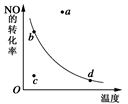
| A.a点 | B.b点 | C.c点 | D.d点 |
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是()
CH3COO-+H+对于该平衡,下列叙述正确的是()
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
氨的催化氧化4NH3(g)+5O2(g) 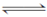 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
| A.以O2浓度变化表示的反应速率为0.064 mol·(L·s)-1 |
| B.反应达到平衡状态时NH3的转化率为20% |
C.升高温度能使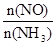 减小 减小 |
| D.将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol·L-1 |
下列电离方程式正确的是()
A.NaHSO4 Na++H++SO42一 Na++H++SO42一 |
B.NaHCO3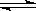 Na++ HCO3一 Na++ HCO3一 |
C.H2S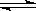 2H++S2- 2H++S2- |
D.Mg(OH)2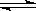 Mg2++2OH- Mg2++2OH- |