
请回答:
(1)各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 |
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
| ① |
0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② |
0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
| ③ |
0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下: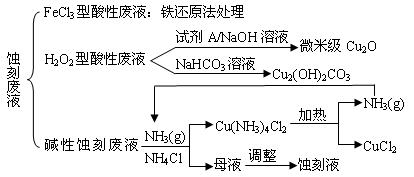
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 ▲ 、 ▲ 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
▲ 。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 ▲ (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 ▲ 。
⑸ 碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 ▲ 。
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
⑴写出钛铁矿经氯化得到四氯化钛的化学方程式:▲。
⑵由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将▲(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2▲t。
⑶用甲醇-空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),
在接通电路一段时间后纯Cu质量增加6.4 g。
①请写出燃料电池中的负极反应式:▲。
②燃料电池正极消耗空气的体积是▲(标准状况,空气中O2体积分数以20%计算)。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A—E为实验室 常见的仪器装置(部分固定夹持装置略去),请根据要求
常见的仪器装置(部分固定夹持装置略去),请根据要求 回答问题。
回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 ▲ 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
▲ ,写出制纳米级碳酸钙的化学方程式: ▲ 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级。
▲ 。
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: ▲。
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)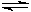 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将▲(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2▲t。
(3)用甲醇—空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),
在接通电路一段时间后纯Cu质量增加3.2 g。
①请写出燃料电池中的负极反应式:▲。
②燃料电池正极消耗空气的体积是▲(标准状况,
空气中O2体积分数以20%计算)。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: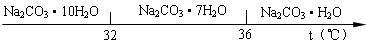
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c( M
M g2+):c(Fe3+)=▲。
g2+):c(Fe3+)=▲。
(2 )“趁热过滤”时的温度应控制在
)“趁热过滤”时的温度应控制在 ▲。
▲。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行▲,并说明理由:
▲。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 53 2.36kJ·mol-1
2.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g)△H=+ 473.63kJ·mol-1
(s)=Na2CO3·H2O(s)+9 H2O(g)△H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式▲。