在某温度下,可逆反应m A (g)+n B (g) 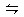 p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 ( )
p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 ( )
| A.K越大,达到平衡时,反应进行的程度越大 |
B.K的表达式是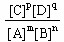 |
| C.K随反应物浓度的改变而改变 |
| D.K随温度的改变而改变 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t1min内 CH3OH的平均生成速率为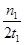 mol·L-1 min-1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平 |
衡时 减小
减小
下列离子方程式书写正确的是
| A.三氯化铁溶液中加入铁粉:Fe3+ + Fe ═ 2Fe2+ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH— ═ Al(OH)3↓ |
| C.苯酚钠溶液中通入少量CO2:CO2 + H2O + C6H5O-→ C6H5OH + HCO3- |
| D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl— = Mn2++Cl2↑+2H2O |
下列说法中正确的是
| A.CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质 |
| B.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C.煤油可由石油分馏获得,可用于保存少量金属钠 |
| D.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的 |
氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是
| A.LiH的水溶液显中性 |
| B.LiH中的氢离子可以被还原生成氢气 |
| C.LiH是一种强氧化剂 |
| D.LiH中氢离子比锂离子的半径大 |
下列离子在指定条件下能大量共存的是
| A.在酸性溶液中:Ba2+、K+、SO32―、Cl― |
| B.含有大量Al3+的溶液中:K+、Na+、NH4+、SO42― |
| C.使甲基橙变黄的溶液中:Na+、I―、CO32―、OH― |
| D.无色溶液中:K+、Cl―、Cr2O72-、HCO3― |