一定温度下,在容积为V L的密闭容器中进行反应:aM(g) bN(g),M、N的物质的量随时间的变化曲线如图所示:
bN(g),M、N的物质的量随时间的变化曲线如图所示: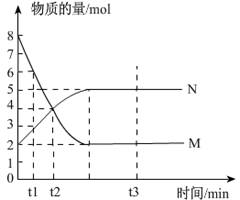
(1)此反应的化学方程式中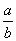 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________________
(3)下列叙述中能说明上述反应达到平衡状态的是__________
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
写出有关反应方程式
(1) 由苯制溴苯_______________________________
(2) 由乙炔制聚氯乙烯_______________________________________
(3) 杯状化合物A可作为金属离子配合物的配体,其结构如图:选用均不超过10个碳原子的两种有机物为原料,经缩合生成A。_________________________________。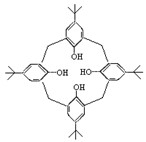
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下: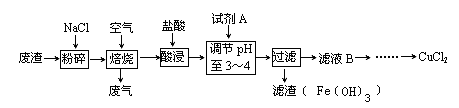
焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是(写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)
(共10分)
(1)已知可逆反应:M(g)+N(g)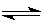 P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为_______________。
| A.加入一定量M | B.加入一定量N |
| C.反应温度升高 | D.缩小容器体积 |
E.加入某物质作催化剂 F.分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为_______________。此反应的化学平衡常数K=_______________。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=_______________mol·L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子(电子转移的方向如下图所示),电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2===2CO2+4H2O。则c电极是(填“正极”或“负极”),c电极上发生的电极反应式为_____________________________________________。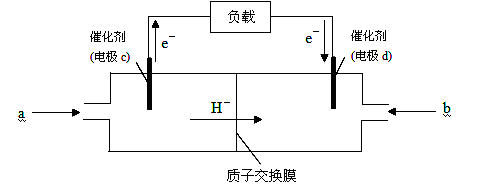
A、B、C、D、E、F 是六种短周期的主族元素,它们的原子序数依次递增;A元素与其它元素均不在同一周期,C元素与B、D元素同周期相邻;C元素的最高价氧化物对应水化物与C元素的气态氢化物X能相互反应生成盐Y;D、F元素同族,E是短周期主族中原子半径最大的元素。请完成下列问题:
(1)D位于元素周期表第__________周期__________族。
(2)E原子的结构示意图为__________。
(3)D和F两元素相比较,非金属性较强的是__________填元素名称),可以验证该结论的事实是__________________________________________________(只写一个即可)。
(4)A、D和E三种元素组成的化合物,其所含的化学键类型有____________________。
(5)检验X的试剂或试纸是__________。
(6)由A、C、D三种元素组成的两种强电解质甲和乙,它们的水溶液均呈酸性。若甲抑制水的电离,则甲的化学式为__________ ;若乙促进水的电离,则乙的水溶液呈酸性的原因是(用离子方程式表示)______________________________________________。
(7)写出D、E两元素形成的原子个数比为1:1的化合物与水反应的化学方程式:
____________________________________________________________ 。
(8)A与D间可形成负一价双原子阴离子,有10个电子,写出该阴离子与盐酸反应的离子方程式__________________________________________________。
(9)已知0.4mol 液态C2 A4与液态双氧水反应,生成C2和液态水,放出327.2 kJ的热量,该反应的热化学方程式为__________________________________________________。
(10)D、E、F简单离子半径由大到小的顺序为:______________________________(用离子符号表示)。
(11)写出A、D两种元素形成的化合物的一种用途______________________________。
某课外活动小组同学用右图装置进行实验,试回答下列问题。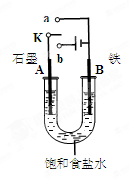
(1)若开始时开关K与b连接,则B极的电极反应式为________________________
总反应的离子方程式为________________________。
有关上述实验,下列说法正确的是(填序号)________________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为________________。