2002年诺贝尔化学奖的一半奖金授予了瑞士科学家库尔特维特里希,以表彰他“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。核磁共振技术是利用核磁共振谱来测定有机化合物结构,最有实用价值的就是氢谱,常用HNMR表示,如:乙醚分子中有两种氢原子,其HNMR谱中有两个共振峰,两个共振峰的面积比为3:2,而乙醇分子中有三种氢,HNMR谱中有三个峰,三个共振峰之间的面积比为3:2:1。
(1)请写出分子式C4H8在HNMR谱中两个峰面种为3:1的化合物的结构简式______。
(2)C4H10的HNMR谱有两种,其中作液体打火机燃料的C4H10的HNMR谱的两个峰的面积比为__________,结构简式__________;其同分异构体的两个峰的面种比为_________,结构简式为________________________。
由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料。
(1)J中所含官能团的名称为;K中所含官能团的结构简式为
(2)聚合物F的结构简式是;I的分子式是。
(3)E转化为G的化学方程式是;反应类型属于
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式。
(5)写出J 的一种符合下列条件的同分异构体X结简式。
①1mol X可以与3mol NaOH反应 ②X分子中氢原子核磁共振氢谱有4个峰,
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X原子核外电子占有9个原子轨道 |
X的一种氧化物是形成酸雨的主要物质 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第周期第族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH(填“=”、“>”或“<”),理由是:(用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式。
多彩水泥的添加剂是CoCl2-6H2O。工定是以含钴废料(含少量Fe、Al等杂质制取CoCl2·6H2O的一种新工艺流程如下图: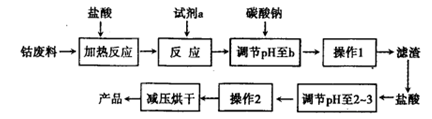
已知:①钴与盐酸反应的化学方程式为:Co+2HClCoCl2+H2↑
②CoCl2·6H2O溶点86oC,易溶于水、乙醚等;常温下稳定无毒,加热至110oC~120OC时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)上述流程中的试剂a可能为;其作用是;
(2)加入碳酸钠调节pH至b,b的范围是;
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀(pH) |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀(pH) |
4.1 |
9.7 |
9.2 |
5.2 |
(3)操作1是;滤渣的成分为;
(4)操作2的过程为蒸发浓缩、和过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
(1)A在核磁共振氢谱中有种峰;
(2)反应①为取代反应,该步反应物Me2SO4中的“Me”的结构简式表示:;
(3)E中的含氧官能团有:(写名称);
(4)写出反应②、⑤的反应类型:、;
(5)F、H的结构简式分别为、;
(6)请写出反应④的化学方程式:。
A、B、C、D、E、F周表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
A是周期表中原子半径最小的元素 |
| B |
B元素的原子价电子排布为ns11np14 |
| C |
M的基态原子L层电子数是K层电子数的3倍 |
| D |
D是第三周期中第一电离能最小的元素 |
| E |
E是地壳中含量最多的金属元素 |
| F |
有多种化合价,其某种高价阳离子的价电子具有较稳定的半充满结构 |
(1)F位于元素周期表中位置,其基态原子核外价电子排布式为;
(2)B的电负性比M的(填“大”或“小”);B2A3分子中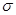 键与
键与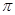 键与个数之比为;
键与个数之比为;
(3)写出E的单质与D的最高价氧化物的水化物溶液反应的化学方程式:;
(4)已知每5.4gE可与最低价F的氧化物反应,放出346.2kJ的热量。则请写出该反应的热化学方程式:。