某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。
(1)能选用四氯化碳在碘水中萃取碘的原因是____________________________;
(2)其实验操作可分解为如下几步:
A.把盛有溶液的漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
①正确操作步骤的顺序是(用上述各操作的编号字母填写):_________________;
②下列物质,不能作为从溴水中萃取溴的溶剂是_________。
A、热裂汽油 B、苯 C、酒精 D、四氯化碳
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂、浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_____________________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________________________________________________________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
 |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| 对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
|||
| 浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
| NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________________________________________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有________________、________________。
苯乙醚是一种无色油状液体,熔点-30 ℃,沸点 172 ℃,不溶于水,易溶于醇和醚,广泛用于有机合成中间体及制造医药、染料等。实验合成的原理为:
主要实验步骤如下:
(Ⅰ)合成:在烧瓶中(装置如图)加入7.53 g苯酚、3.92 g NaOH和4 mL水,开动搅拌器,使固体全部溶解,加热反应器控制温度80~90 ℃之间,并用滴液漏斗慢慢滴加8.59 mL溴乙烷(沸点38.4 ℃),大约40 min滴加完毕,继续搅拌1 h,冷却至室温。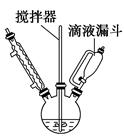
(Ⅱ)分离与提纯。
①加入适量的水(10~15 mL)使固体完全溶解,将液体转入分液漏斗中,分出水相;
②水相用8 mL乙醚萃取一次,与有机相合并;
③有机相用等体积饱和食盐水洗两次,分出水相,再将水相用6 mL乙醚萃取一次,与有机相合并;
④有机相用无水氯化钙干燥;
⑤先用水浴蒸出乙醚,然后常压蒸馏,收集148 ℃稳定的馏分得苯乙醚;
⑥称量产品质量3.69 g。
回答下列问题:
(1)用图示的滴液漏斗代替普通漏斗滴液,其优点是_______________________。
(2)合成时,开动搅拌器的目的是_______________________________。
(3)控制温度80~90 ℃可采用的方法是________________,两次用乙醚萃取的目的是________________________________________________________。
(4)蒸馏时最后温度稳定在148 ℃左右,其原因是_________________
_______________________________________________________。
(5)本次产率为12.4%,产率偏低的原因可能有__________________________
______________________________________________。
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下: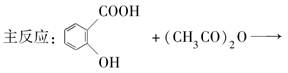
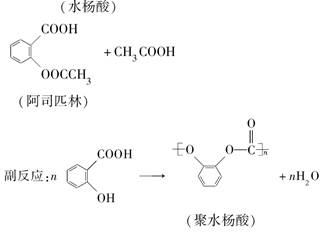
阿司匹林(乙酰水杨酸)的钠盐易溶于水。阿司匹林可按如下步骤制取和纯化: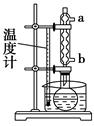
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解。
步骤2:按图所示装置装配好仪器,通水,在水浴上加热回流5~10 min,控制水浴温度在85~90 ℃。
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、抽滤、冷水洗涤2~3次,继续抽滤得粗产物。
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤。
步骤5:将滤液倒入10 mL 4 mol·L-1盐酸,搅拌,将烧杯置于冰浴中冷却,使结晶完全。抽滤,再用冷水洗涤2~3次。
(1)步骤1浓硫酸的作用可能是________。
(2)步骤2中,冷凝管通水,水应从________口进(填“a”或“b”)。
(3)步骤3抽滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是______________________________________________________________。
(4)步骤4发生主要反应的化学方程式为_____________________;过滤得到的固体为________。
(5)取几粒步骤5获得的晶体加入盛有5 mL水的试管中,加入1~2滴1%三氯化铁溶液,发现溶液变紫色,可采用________方法,进一步纯化晶体。
碳酸钠—过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水里,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15 ℃左右反应1 h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤、干燥得产品。
(1)第1步中,稳定剂与水反应生成两种常见的难溶物,其化学方程式为___________________________________________________________。
(2)第2步中,反应保持为15 ℃左右可采取的措施是_____________________
___________________________________________________。
(3)第3步中,无水乙醇的作用是____________________________________。
(4)H2O2的含量可衡量产品的优劣。现称取m g(约0.5 g)样品,用新煮沸过的蒸馏水配制成250 mL溶液,取25.0 mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250 mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒________、________;
②滴定终点观察到的现象是______________________________________。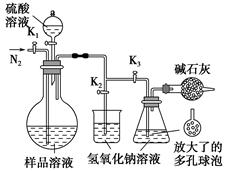
(5)可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50 mL于烧瓶中。
步骤3:准确量取40.00 mL约0.2 mol·L-1 NaOH溶液两份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经分液漏斗向烧瓶中加入10 mL 3 mol·L-1硫酸溶液。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤1~7重复两次。
①步骤3中,准确移取40.00 mL NaOH溶液所需要使用的仪器是________;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是________(填序号);
③为获得样品中碳酸钠的含量,还需补充的实验是______________________。