夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。下图是北京鸟巢试放烟火奥运五环图,并回答下列问题:

 ⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”变化。
⑴火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”变化。 ⑵ 现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体且发现只有氯元素的化合价发生变化。请写出该反应的方程式
⑵ 现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体且发现只有氯元素的化合价发生变化。请写出该反应的方程式  ⑶下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
⑶下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:

 ①B的水溶液呈弱酸性,其主要的电离方程式可表示为_______________________,D的化学式是_________.
①B的水溶液呈弱酸性,其主要的电离方程式可表示为_______________________,D的化学式是_________. ②A、B、E中均含有的一种元素符号为______________。
②A、B、E中均含有的一种元素符号为______________。 ③C与纯碱反应的化学方程式为____________________。
③C与纯碱反应的化学方程式为____________________。 ④液态B与液态E反应可生成一种单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______________________。
某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________________、______________________。
⑵在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应
是反应。
⑶若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入 (填写字母)。
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
然后,再通过(填实验操作名称)即可除去。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: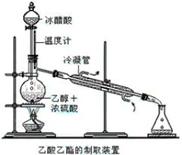
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中加入一定比例的乙醇和浓硫酸的方法是:
。
(2)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,生成乙酸乙酯的物质的量小于1mol,原因是。
(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
试剂a是__________;分离方法①是_________________,
分离方法②是__________________,分离方法③是_______________。
(4)在得到的A中加入无水碳酸钠粉末,振荡,是。
(16分)选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂__________,方法________________________________________。
(2)溴苯(溴)试剂__________,方法___________________________________________。
(3)苯(甲苯)试剂________,方法____________________________________________。
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、_________、_________、尾接管、锥形瓶
Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是__
①为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
②用托盘天平称取10.4 g食盐时,将食盐放在右盘中的纸片上称量
③配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
Ⅱ.201 1年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137。在
被辐射地区,每天服用一片碘片可以起到一定的预防作用。我国部分地区出现抢购加碘食盐现象。为此卫生部有关专家指出多吃碘盐起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购。碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片。
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20—30毫克。
KIO3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶
液,总反应方程式为:KI+3H2O====KIO3 +3H2↑。
Na2S2O3可与I2反应:I2+2S2O32-(无色)→2I—+ S4O62-(无色)。回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是;以每公斤食用盐中碘含量为20毫克计,人每天吃____公斤盐才相当于服用一片碘片。说明靠吃碘盐来预防放射性碘(填“有”、“无”)作用。
(2)电解法制KIO3中,阳极的电极反应式为____;阴极附近pH值(填“增大”、“减小”、“不变”)。
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测。下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0 g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的
淀粉- KI溶液,结果溶液呈蓝色,有关反应的离子方程式为;
②用0.010mol·L—1的Na2S2O3溶液滴定,当用去Na2S2O3溶液12.00mL时蓝色刚好褪去,
该加碘食盐中KIO3的含量为mg/kg。由此可判定该食盐为(填“合格”或“不合格”)产品。
(8分)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是
I;II;III;IV(将下列有关试剂的序号填入空格内)
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是。
(3)使用装置II的目的是。
(4)使用装置III的目的是。
(5)确定含有乙烯的现象是。