现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1、M2、M3,并依次增加14。经分析,相对分子质量为M2的酯,其中氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。
请完成下列问题:
(1)相对分子质量为M2的酯的分子式为______________________________。
(2)饱和一元羧酸的分子式分别为______________________,______________________。
(3)参加反应的醇的结构简式为_______________、_______________、_______________、_______________(不必填满)。
(4)与相对分子质量为M1的酯互为同分异构体,能发生银镜反应,能与金属钠反应产生氢气的有机物的同分异构体有_______________种。
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:__________________。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.8×10-13,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=______________(保留三位有效数字)mol/L。
请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂:a.水 b.NaOH溶液 c.溴的CCl4溶液 d.饱和Na2CO3溶液
e.新制CaO f.饱和NaCl溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 F.盐析 |
| 混合物 |
需加入的试剂 |
分离方法 |
| 苯(苯酚) |
||
| 高级脂肪酸钠(甘油) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)C的元素符号为 D2+的电子排布式为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
该化合物的化学式为_________;D的配位数为_______;该晶体的密度为_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO②TiCl4+2Mg
TiCl4+2CO②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化: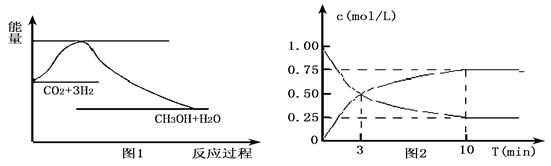
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)=;
H2的转化率w(H2) =。
②该反应的平衡常数表达式K=。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。