某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 时间 |
0 |
2 |
3 |
4 |
| 800 |
℃ |
800 |
℃ |
|
| 1 |
1.0 |
c2 |
c3 |
1.0 |
| 10 |
0.80 |
0.60 |
0.92 |
0.20 |
| 20 |
0.67 |
0.50 |
0.75 |
0.20 |
| 30 |
0.57 |
0.50 |
0.63 |
0.20 |
| 40 |
0.50 |
0.50 |
0.60 |
0.20 |
| 50 |
0.50 |
0.50 |
0.60 |
0.20 |
| 60 |
0.50 |
0.50 |
0.60 |
0.20 |
(1)实验1中,反应在10至20分钟内平均化学反应速率为v(A)=______________。
(2)实验2中,A的初始浓度c2=______________mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件可能是_______________。
(3)若实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3______________v1(填“<”“>”或“=”=,且c3______________(填“<”“>”或“=”=1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应的正反应是______________(填“吸热”或“放热”反应)。理由是__________________________________________________________________。
(14分)已知:①NaNO2具有强氧化性
②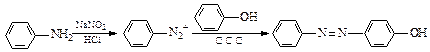
奥沙拉秦是一种抗菌药。其合成路线如下: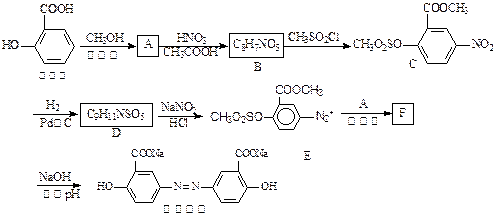
(1)写出下列反应的化学方程式:
水杨酸→A▲;A→B▲。
(2)写出D的结构简式▲。
(3)写出下列反应的反应类型:D→E▲,F→奥沙拉秦▲。
(4)整个合成路线看,设计B→C步骤的作用是▲。
(5)F的结构简式为 ▲。
▲。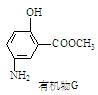
(6)有机物G(结构简式见上图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为▲。
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为▲。
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。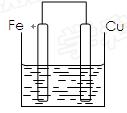
(1)铁片上的电极反应式为,铜片上的电极反应式为,铜片周围溶液会出现的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为mo1,该段时间内用硫酸铜表示的平均反应速率为。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入(填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是mo1/min。(以上均假设反应过程中溶液体积不变)。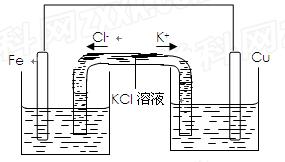
(8分)①1mol有机物HCHO(甲醛)完全燃烧耗O2的物质的量为。
② 1mol有机物CH3COOH完全燃烧耗O2的物质的量为。
1mol有机物CH3COOH完全燃烧耗O2的物质的量为。
③有机物CnHmOc完全燃烧时需要O2的物质的量是该有机物的n倍,则n:m:c=且n、m满足的关系式为。
(8分)①M克CO与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后,固体增重克。
②在100℃时,2克H2与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后,固体增重克。
③在100℃时,A克CO和H2混合气体与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后固体增重恰好为A克,则CO和H2的物质的量的比为。
④在100℃时,容积不变的密闭容器中充入一定量的CH4,O2,Na2O2 在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为。
在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为。
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式。C2A4和A2D2既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2既具有氧化性又具有还原性的原因
。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程: ,该化合物与CA3和A2D的熔点由高到低的顺序为(用化学式表示)。
,该化合物与CA3和A2D的熔点由高到低的顺序为(用化学式表示)。
(3)燃料电池是一种新型电池。由一种日常生活中最常见的有机物(分子式为B2A6D)与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式:。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃。CA3、A2D、EA3的热稳定性由强到弱的顺序为(用化学式表示)。