历史上最早应用的还原性染料是靛蓝,其结构简式如图所示:
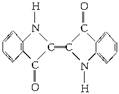
下列关于靛蓝的叙述错误的是( )
| A.靛蓝由碳、氢、氧、氮四种元素组成 | B.它的分子式是C16H10N2O2 |
| C.该物质是高分子化合物 | D.它是不饱和的有机物 |
下列叙述正确的是( )
| A.石油裂化主要得到乙烯 |
| B.石油分馏是化学变化,可得到汽油、煤油等 |
| C.煤的干馏主要得到煤焦油、焦炉气、焦炭、粗氨水 |
| D.煤的气化和液化是物理变化,是使煤变成清洁能源的有效途径 |
下列有关化学与生活、工业的叙述中,正确的是()
| A.工业上生产水泥、玻璃、陶瓷,均需要用石灰石为原料 |
| B.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能 |
| C.面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 |
| D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同 |
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 ml | B.336 ml | C.224 ml | D.168 ml |
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
| A.溶液的pH相同 |
| B.分别加入足量锌片,盐酸生成的H2体积大 |
| C.分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D.由水电离出的氢离子浓度均为1×10-12 mol·L-1 |
室温下,将0.100 0 mol·L-1盐酸滴入20.00 ml 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图。下列有关说法不正确的是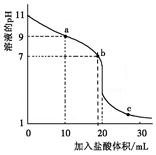
| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.a、b、c点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.b点:c(M+)+c(MOH)=c(Clˉ) |