已知: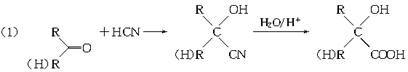
(2)R—CHCH2+HBr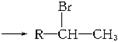
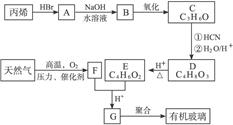
有机玻璃可按下列路线合成:
F亦可由水煤气在高温、高压、催化剂存在下合成。试写出:
(1)天然气的主要成分和C的结构简式分别为_________、_________。
(2)E+F G的反应方程式为______________________________________。
G的反应方程式为______________________________________。
(3)丙烯 A和A
A和A B的反应类型分别属于___________、___________。
B的反应类型分别属于___________、___________。
(4)G 有机玻璃的反应方程式为__________________。
有机玻璃的反应方程式为__________________。
丰富多彩的化学物质不断改变着人类的生活,它们所产生的作用与其分子结构密切相关。
(1)请根据以下化合物的分子结构,回答下列问题: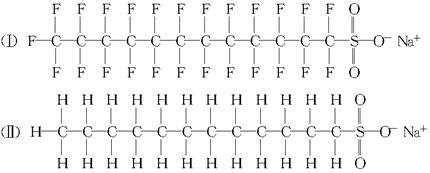
①上述化合物可能的应用是________。
A.化合物(Ⅰ)可作为制造聚四氟乙烯塑料的原料;化合物(Ⅱ)可用来合成人造纤维
B.两者均可作为食品添加剂
C.两者均可作为表面活性剂,起到乳化、增溶、消泡等作用
D.两者均可用作中和胃酸的药物
②上述两个化合物进入环境后,更难被降解的是________。
(2)有三种高分子材料,结构单元如下:
请回答下列问题:
①根据上述高分子结构,能够作为高吸水性树脂的是________,其可能的理由是______________________;可作为弹性橡胶的是________,理由是________________________________________________________________________。
②有关上述高分子材料的下列说法正确的是________(可多选)。
A.高分子(Ⅴ)的单体有4种
B.高分子(Ⅲ)焚烧后产生的废气毒性最小
C.都能作为食品包装材料
D.它们的废弃物都可以回收利用
聚四氟乙烯的耐热性和化学稳定性都超过了一般塑料,甚至在王水中也不变化,故号称“塑料王”,在工业上有着广泛的用途。其合成路线如图所示: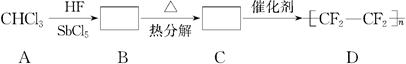
(1)在方框中填入合适的有机物的结构简式。
(2)写出下列化学反应方程式,并指出反应类型。
B―→C________________________________________________________,
反应类型是____________;
C―→D_____________________________________________________________,
反应类型是____________。
现有下列高聚物: ;B.天然橡胶树脂;C.硫化橡胶;D.用于制电木的酚醛树脂;E.有机玻璃,其中属于线型结构的是________,属于体型结构的是________,可溶于有机溶剂的是______,加热能熔融的是________,用于制备轮胎的是________,用于制备车窗玻璃的是________,用于制备插座、电器把手的是________。
;B.天然橡胶树脂;C.硫化橡胶;D.用于制电木的酚醛树脂;E.有机玻璃,其中属于线型结构的是________,属于体型结构的是________,可溶于有机溶剂的是______,加热能熔融的是________,用于制备轮胎的是________,用于制备车窗玻璃的是________,用于制备插座、电器把手的是________。
下列所含分子数由多到少的排列顺序是,
| A.标准状况下33.6 L H2 | B.所含电子的物质的量为4 mol的H2 |
| C.20 ℃时45 g H2O | D.常温下,16 g O2与14 g N2的混合气体 |
E.含原子总数约为1.204×1024的NH3
写出下列实验或反应对应的离子方程式:
(1)FeBr2溶液中通入少量氯气,
(2)NH4HCO3溶液加入过量的NaOH溶液
(3)石灰乳与NaCO3溶液混合,
(4)三氯化铁溶液与过量氨水反应
(5)氯气通入氢氧化钠溶液中
(6)惰性电极电解熔融氯化钠,
(7)用氢氧化钠溶液去除铝表面的氧化膜,
(8)用食醋去除水瓶中的水垢
(9)小苏打与氢氧化钠溶液反应.