(A)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所
得固体M的成分,设计了如下图装置。
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)。
由上述实验事实可知:
(1)①固体M中一定有的物质是_____________ (填化学式),理由是___________________________________________________________________________________________________。
②其中一种物质的质量可以确定为______________g(用代数式表示)。
(2)B装置的名称是______________。
写出B装置中反应的离子方程式___________________________。
(3)C装置的作用是___________________________,如果实验中没有B装置,则C装置中产生的现象是________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是______________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是______________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是______________。
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
三氯化碘(ICl3 ,I的化合价为+3价)在药物合成中用途非常广泛,其熔点:33℃,沸点73℃。实验室可用如图装置制取ICl3。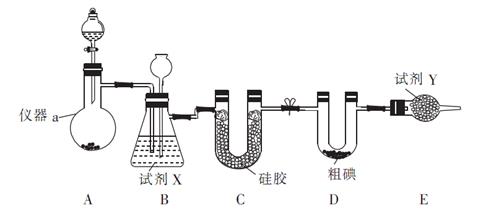
(1)试剂X、Y分别是: 、 。装置E的作用是: 。
(2)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为: 。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(4)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
(5)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI=2I2+3KCl(样品中杂质不反应)。将所得溶液配置成100mL待测液。取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2 S2O32--=2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为: 。重复滴定3次,测得消耗Na2S2O3溶液体积的平均值为20.00mL。该样品中ICl3的质量分数为: 。(ICl3相对分子质量为233.5)
实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
KI在食品、医药领域有广泛用途。某科研小组利用碘废弃液(主要含I2、I-)制备KI,流程如下:
已知:I2+2S2O32-==S4O62-+2I-
(1)加入胆矾的作用 。
(2)为制得KI晶体粗产品,滤液后续操作步骤是 。
(3)用沉淀滴定法测定样品中KI含量的实验步骤如下:
a.称取3.000 g样品,溶解,配制成250 mL溶液
b.量取25.00 mL待测液于锥形瓶中
c.用0.1000 mol•L-1AgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液16.50 mL
①配制250mL样品溶液时,所需的仪器除烧杯、玻璃棒之外,还缺少的玻璃仪器是 。AgNO3标准溶液在使用之前通常要重新标定,原因是 ;本实验滴定过程中操作滴定管的图示正确的是______(填编号)。
③该样品中KI的质量百分数为 。
④下列因素会导致KI含量的测定结果偏高的是 。
| A.配制样品溶液定容时仰视 |
| B.锥形瓶未干燥 |
| C.滴定管未用AgNO3标准溶液润洗 |
| D.滴定终点时滴定管尖嘴中产生气泡 |
硫酸铵是常见的化肥,是强酸弱碱盐,室温下,可用酸碱滴定法测定其氮元素的含量,但由于NH4+的酸性太弱(Ka=5.6×10-10),直接用NaOH标准溶液滴定有困难,生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。甲醛法是基于甲醛与一定量铵盐作用,生成酸(H+)和六次甲基四铵盐(Ka=7.1×10-6)反应如下:4NH4++ 6HCHO=(CH2)6N4H++ 6H2O+ 3H+,生成物可用酚酞为指示剂,用NaOH标准溶液滴定[在室温下(25℃),通常Ka表示弱酸的电离平衡常数,Kb表示弱碱的电离平衡常数]。硫酸铵含氮量的测定步骤如下:
①准确称取1.800g (NH4)2SO4于烧杯中。
②用适量蒸馏水溶解,然后定量地移至250mL容量瓶中,并用蒸馏水稀释至刻度,摇匀备用。
③用移液管移取试液25mL于锥形瓶中,加入8mL 1:1的甲醛溶液,再加入1~2滴酚酞指示剂摇匀,静置一分钟后,用0.100 mol/L NaOH标准溶液滴定至溶液呈浅红色持续半分钟不褪色,即为终点。
④记录读数,平行做2~3次,NaOH标准溶液滴定消耗的平均体积为27.00mL。
根据实验回答下列问题:
(1)硫酸铵水溶液呈酸性的原因是__________________________________。(用离子方程式说明)
(2)步骤①称取硫酸铵固体样品是否能使用托盘天平______________(填“是”或“否”)。
(3)步骤③加入的甲醛溶液使用前需要加入一定量的NaOH,原因是________________________。
(4)NH4NO3中氮的百分含量是否能用该方法测定______________(填“是”或“否”)。原因是
_________________________________。
(5)据题目给出的信息计算样品中氮的百分含量为_________________ ____。
(6)若室温下,C mol/L氨水的电离平衡常数为Kb,则该氨水的电离度a=_________ ____。(用C
和Kb表示),由此在恒定温度下,你能得出的结论为_________________ ____。
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: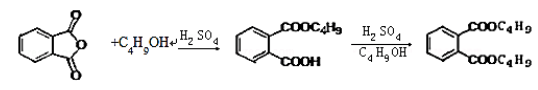

已知:正丁醇沸点118℃,纯邻苯二甲酸二丁酯是无色透明、具有芳香气味的油状液体,沸点340℃,酸性条件下,温度超过180℃时易发生分解。
由邻苯二甲酸酐、正丁醇制备邻苯二甲酸二丁酯实验操作流程如下:
① 向三颈烧瓶内加入30g(0.2mL)邻苯二甲酸酐,22g正丁醇以及少量浓硫酸。
② 搅拌,升温至105℃,持续搅拌反应2小时,保温至反应结束。
③ 冷却至室温,将反应混合物倒出,通过工艺流程中的操作X,得到粗产品。
④ 粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→圆底烧瓶→减压蒸馏,经过处理得到产品20.85g。
请回答以下问题:
(1)步骤②中不断从分水器下部分分离出产物水的目的是 。判断反应已结束的方法是 。
(2)上述实验可能生成的副产物的结构简式为 (填一种即可)
(3)操作X中,应先用5%碳酸钠溶液洗涤粗产品,纯碱溶液浓度不宜过高,更不能使用氢氧化钠;若使用氢氧化钠溶液,对产物有什么影响?(用化学方程式表示) 。
(4)操作X中,分离出产物的操作中必须使用的主要玻璃仪器有 。
(5)粗产品提纯流程中采用减压蒸馏的目的是 。
(6)本实验中,邻苯二甲酸二丁酯(式量是278)的产率为 。