某元素的最高价氧化物为R2O5,该元素的气态氢化物中氢的质量分数为8.82%,已知该元素原子核内中子数比核外电子数多1。试推断:
(1)该元素的名称是__________,在元素周期表中的位置是__________。
(2)该元素的最高价氧化物对应水化物的酸性强弱与同周期元素最高价含氧酸的比较应为(写出化学式)__________。
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: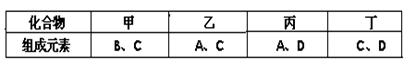
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的化学式为,丁物质中阴离子与阳离子的个数之比为。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为akJ,试写出表示甲物质燃烧热的热化学方程式。
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为。
(4)某同学设计了一个以结构简式是BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图: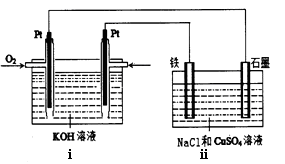

①写出ⅰ中通入该物质这一极的电极反应式。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的pH约为。
A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和强碱溶液反应的离子方程式____________________。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似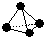 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
 (3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(4) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,其熔沸点比金刚石_____(填“高”、“低”或“无法比较”)。
在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是,同时生成微量的_____;
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程_______________________,______________;
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________________;
(4)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是______________,用电子式表示BeCl2的形成过程:________________________________________。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" " 1451 kJ/mol I3 = 7733kJ/mol I4 =" " 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式;
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈___形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为: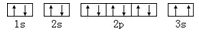 ,该同学所画的电子排布图违背了;
,该同学所画的电子排布图违背了;
(4)G位于族区,价电子排布式为;
(5)DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为。
有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N);
(1)只含有极性键的是__________;只含有非极性键的是__________;既有极性键,又有非极性键的是______________;
(2)只有σ键的是____________;既有σ键又有π键的是__________;
(3)含有由两个原子的s轨道重叠形成的σ键的是__________;
(4)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是____________;
(5)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是__________。