a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 |
a |
b |
c |
d |
e |
f |
g |
h |
| 原子核个数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
多核 |
| 带电荷数(单位:电荷) |
0 |
+1 |
-1 |
0 |
+2 |
+1 |
0 |
+1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:
(1)a微粒原子核外结构示意图: ,c微粒电子式为 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为: > (写化学式)
(3)c微粒和f微粒反应生成2分子g的离子方程式为 。
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为 。
(5)大量微粒g所构成的晶体属 ;d微粒分子结构呈 ;h微粒所构成的晶体中化学键的类型有 。
(共14分)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。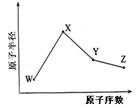
已知W的一种原子的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是同周期中非金属性最强的元素。
(1)Y位于元素周期表的位置 ,X与W元素形成的X2W2型化合物的电子式为
(2)Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中存在的作用力有
其分子属于 (填极性分子或非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是
(4)在25ºC、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子,放热190.0kJ,该反应的热化学方程式是
某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为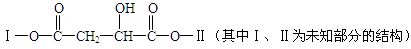
为推测X的分子结构,进行如下图的转化: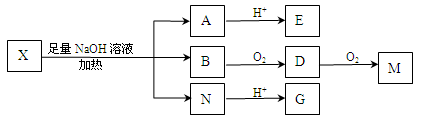
已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。
请回答:
(1)M的结构简式为_____________;G分子所含官能团的名称是______________。
(2)E可以发生的反应有(选填序号)___________。
①加成反应②消去反应③氧化反应④取代反应
(3)由B转化成D的化学方程式是________________________。
(4)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式是__________________。
(5)已知在X分子结构中,I里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是:___________________。
(6)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有________种。
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化
合物的溶液中构成电池,则电池负极反应式为。
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。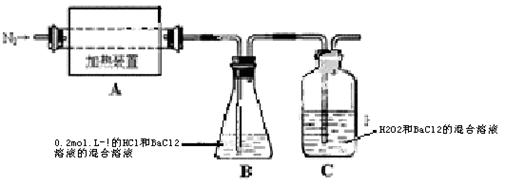
①A中固体充分加热较长时间后,通入氮气,目的是。
②为验证A中残留物是否含有FeO,需要选用的试剂有。
| A.KSCN溶液 | B.稀硫酸 | C.浓盐酸 | D.KMnO4溶液 |
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有气体生成,若含有该气体,观察到的现象为。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
ba(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为(用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O 2Fe2O3•xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是。
2Fe2O3•xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是。
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。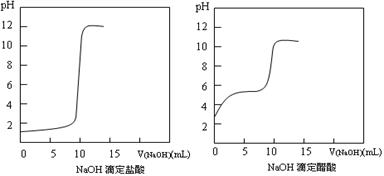
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为;
②滴定开始后醋酸曲线变化比盐酸快的原因是;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为(填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。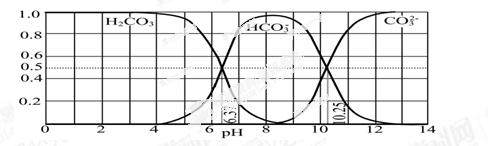
①下列叙述正确的是。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈性(填“酸”、“中”、“碱”),原因是。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)