某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是_______;若用碳酸钠固体与稀硫酸反应应选用的装置是_______。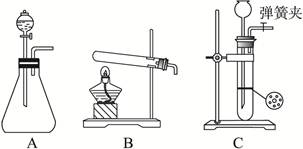
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题: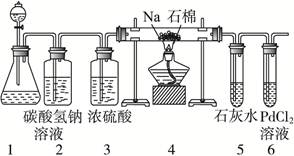
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有Na2O和C。
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2二溴乙烷。某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可用下列反应制备1,2二溴乙烷。某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
回答下列问题:
(1)写出该实验中产生SO2的化学方程式___________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由是________(填正确答案的标号,下同)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是乙烯
C.使溴水褪色的反应,未必是加成反应
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是.
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为_______,其作用是_______ ,B中的试剂为_______,其作用是_______。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗产品进行了精制。该洗涤操作用到的主要玻璃仪器是,该仪器在使用前须清洗干净并。
(14分)下图是某实验小组探究FeSO4固体分解的实验装置。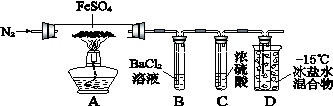
| 实验过程 |
实验现象 |
|
| ① |
通入一段时间N2,加热 |
A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② |
用带有火星的木条靠近装置D的导管口 |
木条复燃 |
| ③ |
充分反应,停止加热,冷却后,取A中固体,加盐酸 |
固体溶解,溶液呈黄色 |
| ④ |
将③所得溶液滴入D试管中 |
溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)加热前通入一段时间N2目的是__________________________________。
(2)实验③反应的离子方程式是__________________________________。
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________________________________。
(4)实验④反应的离子方程式是___________________________________________。
(5)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)__________________________________。
(6)有人认为省略B装置同样可以检验是否有产物SO3,若你认为正确,理由是(若你认为不正确,此问不答。)___________________________________________。
(15分)氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)左装置图中球形干燥管的作用是。
(2)完成以下实验步骤:组装好实验装置,首先,再加入实验药品。接下来的实验操作是:关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是。
【方案3】按下图步骤测定样品中AlN的纯度:
(6)AlN的质量分数计算的表达式是。
(7)若在步骤③中未洗涤,测定结果将(填“偏高”、“偏低”或“无影响”)。
某校化学兴趣小组的学生应用下图所示的方法研究氯气的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题: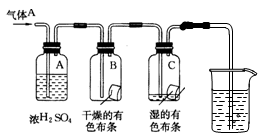
(1)上图中,浓H2SO4的作用是_____
(2)实验中,B试剂瓶的实验现象是,C试剂瓶的实验现象是____________,导致C中出现相应现象的物质是(填化学式)。
(3)为了对尾气进行处理,最后的烧杯中应当加入溶液,反应的离子方程式为。
某学生利用以下装置探宄氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。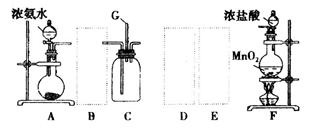
请回答下列问题:
(1)装置A中的烧瓶内固体可选用_______________(选填以下选项的代号)。
A.碱石灰
B.五氧化二磷
C.二氧化硅
D.生石灰
E.固体烧碱
(2)装置F中发生反应的离子方程式:_______________________。
(3)虚线框内应添加必要的除杂装置,请从下图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。(均填编号)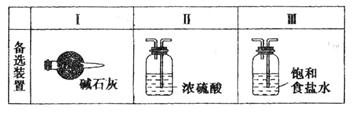
(4)装置C内出现浓厚的白烟并在容器内壁凝结,写出反应的化学方程式并配平:
__________________________________________。
(5)从装置C的出气管口处逸出的尾气可能会污染环境,用装有______试剂的洗气瓶处理。