某钠盐溶液可能含有阴离子,,, ,, , 。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加后,生成无色无味气体。该气体能使饱和石灰水溶液变浑浊;
③加,滴加少量氯水,振荡后,层未变色;
④加溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解;
⑤加酸化后,再加过量,溶液中析出白色沉淀。
(1)分析上述 5 个实验,写出每一实验鉴定离子的结论与理由。
实验①;
实验②;
实验③;
实验④;
实验⑤;
(2)上述 5 个实验不能确定是否存在的离子是。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。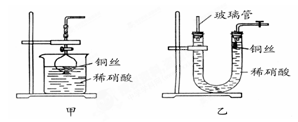
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________________________________(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是__________________________________。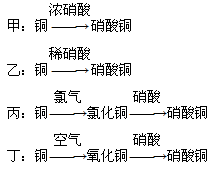
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。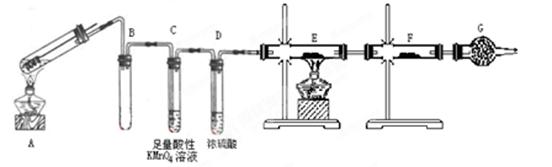
(1)填写装置的作用:B ,C,G。
(2)先点燃处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作。
(3)证明有SO2生成的现象是。
(4)可以证明气体X中含有氢气的实验现象是:________________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是__________________________。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。
自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下: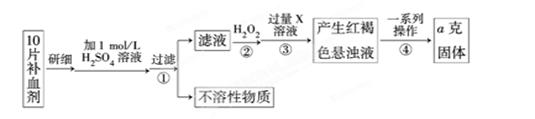
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是。
(2)步骤③中反应的离子方程式为。
(3)步骤④中一系列处理的操作步骤是:过滤、、灼烧、、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为g(用含a的代数式表示)。
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) 。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是。
(15分)二氧化硫是大气污染物之一,为粗略测定周围环境中二氧化硫的含量,某课外活动小组的甲、乙两位同学分别用相同实验装置和溶液,测定同一时间,同一地点空气(含SO2、N2、O2气体,其他气体忽略)中SO2的含量。实验装置如右图反应试管中装有碘的淀粉稀溶液A。 SO2和I2发生反应为:S02+I2+2H20=H2SO4+2HI(N2、02不与I2、淀粉反应),试回答下列问题: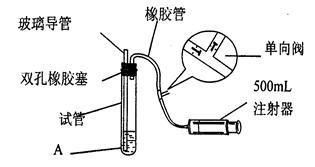
(1)检查该装置气密性时,先在试管中装入适量的水(保证玻璃管的下端浸在水中),然后_____________________(注意阀的单向性),则证明该装置的气密性良好。
(2)若A溶液的体积为VmL,浓度为c mol·L-1,当溶液的颜色刚好变色,停止抽气,此时甲、乙两位同学注射器内抽得气体的体积分别为V甲mL、V乙mL(所有的体积已折算成标况下体积),且V甲>V乙,则甲、乙两个测定结果中与该地点空气中S02的体积分数真实情况最接近的是_______________________(.用含c、V、V甲或V乙…等的关系式表示)。另一位实验结果产生较大误差的原因可能是_______________________________________________
(3)若将上述装置进行改进,除导管外,重新连接装置需要选用的仪器有___________________。 (选下列仪器的编号)
a、烧杯 b、试管 c、锥形瓶 d、容量瓶e、量筒 f、单孔塞 g.双孔塞
(4)欲净化空气,除去空气中的二氧化硫可选用的试剂是___________________。
(7分)试回答下列(1)、 (2)两小题
(1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 (填代号A、B……)
A.用托盘天平称取29.25g的食盐;
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
C.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
D.用湿润的pH试纸测得某溶液的pH为10
E.做中和滴定实验时,锥形瓶用待测液润洗