镁是一种很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中利用镁制取硅的反应为2Mg+SiO2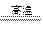 2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si
2MgO+Si(玻璃中含有一定量的二氧化硅),同时有副反应发生:2Mg+Si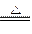 Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。
Mg2Si。Mg2Si遇盐酸迅速反应生成SiH4(硅烷)。SiH4在常温下是一种不稳定、易分解的气体。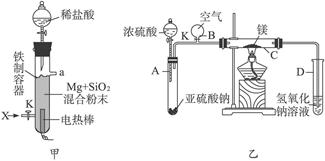
(1)图(甲)是进行Mg与SiO2反应的实验装置。
Ⅰ.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的________________。
Ⅱ.实验开始时,必须先通入X的气体,再接通电源加热反应物。其理由是_____________________________;当反应引发后,切断电源,反应能继续进行,其原因是_____________________________。
Ⅲ.反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知____________________在空气中能自燃。
(2)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
Ⅰ.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为______________________。
Ⅱ.停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯。橡胶气胆B在实验中的作用是_______________________________。
Ⅲ.C中全部反应产物有___________、___________、___________(填化学式)。
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。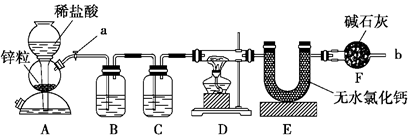
(1)如何检查装置A的气密性?
_
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,其目的是,
其原理是。
(3)为了安全,在点燃D处的酒精灯之前,在b出口处必须。
(4)装置B的作用是;
装置C中装的液体是,所起的作用是。
(5)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是。
(6)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2 g,则混合物中Fe2O3的质量为g。
(7)U形管E右边又连接干燥管F的目的是,若无干燥管F,测得Fe2O3的质量将(填“偏大”、“偏小”或“无影响”)。
(8)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将(填“偏大”、“偏小”或“无影响”)。
. 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(2)实验中判断沉淀是否完全的方法是
方案三:按如图装置进行实验:
(1)B装置内所盛试剂是;D装置的作用是;分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是
:
(每空3分共计21分)
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。
(10分)某化学活动小组设计如图所示装置(部分夹持装置已略去)实验,以探究潮湿的Cl2与Na2CO3反应的产物。
(1)写出装置A中发生反应的化学方程式:________ _____________。
(2)写出试剂Y的名称:__________________ _________________。
(3)将C中反应后的固体物质分成两等份分装于两支试管中,
①向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,写出产生此现象的离子方程式:________ ____________;由此现象推断固体产物中含有______ ____(填化学式,下同);
②向另一支试管中滴加过量的稀硝酸,有无色无味的气体产生,溶液澄清,再向溶液滴加过量的AgNO3溶液,溶液变浑浊,经过滤、洗涤、干燥,得到14.35g固体,由此现象推断固体产物中含有____ ____
(4)已知C中有0.1molCl2参加反应,D中收集到的气体是氯的一种氧化物,由(4)中现象及数据可推知,C中反应的化学方程式为________ ___________。
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为_________________________。(提示,高锰酸钾的还原产物为Mn2+)
(2) B装置的名称是__________;A装置中的固体可能是________。
(3)通入C装置的两根导管左边较长、右边较短,目的是__________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________