根据下列几种物质的熔点和沸点数据,判断下列有关说法中错误的是 ( )
| |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
单质硼 |
| 熔点/℃ |
801 |
710 |
190 |
—68 |
2 300 |
| 沸点/℃ |
1 465 |
1 418 |
182.7 |
57 |
2 500 |
| A.SiCl4是分子晶体 | B.单质硼是原子晶体 |
| C.A1C13加热能升华 | D.MgCl2所含离子键的强度比NaCl大 |
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下: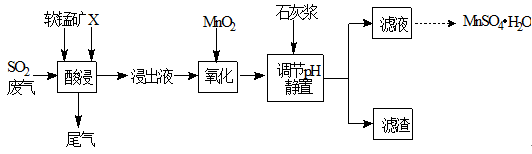
已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
保护环境、保护地球是人类共同的呼声。
① “阅兵蓝”为2015年科技热词。较多排放下列气体不利于蓝天出现的是 (填字母)。
a.NO2 b.N2 c.CO2
② 天然水中含有的细小悬浮颗粒可用 (填字母)作混凝剂进行吸附沉降。
a.Cl2 b.KAl(SO4)2·12H2O c.NaClO
③ 工业废水中含有的Cr3+可用熟石灰作沉淀剂,在pH为8~9 时生成沉淀而除去,生成的沉淀化学式为 。
(2) 食品和药品关系人的生存和健康。
① 下列人体必需元素中,过多摄入 (填字母,下同)元素会引起甲状腺疾病,在牙膏中添加含 元素的化合物可以防治龋齿,儿童缺乏 元素会引发佝偻病。
a.碘b.氟c.钙d.铜
② 下列是生活常用的物质:
a.碳酸氢钠 b.青霉素 c.葡萄糖 d.苯甲酸钠
e.柠檬黄 f.阿司匹林 g.维生素C
上述物质中可用作食品着色剂的是 (填字母,下同);可直接进入血液补充能量的是 ;可用作食品防腐剂的是 ;属于抗生素的是 。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 下列属于复合材料的是 (填字母)。
a.有机玻璃 b.钢化玻璃 c.玻璃钢 d.石英玻璃
② 1928年美国杜邦公司首先合成了尼龙,由尼龙制成的尼龙丝耐磨、柔韧、有光泽,可作为丝绸的代替品,尼龙属于 (填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
③ 制造下列物质时,需要石灰石的是 (填字母)。
a.水泥b.光导纤维 c.陶瓷
④ 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。铁器件在潮湿的空气中会发生 腐蚀(填“化学”或“电化学”),为防止铁质地下管道的腐蚀可在其表面附着 (填“锌块”或“石墨”)。
数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果。已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为 。
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) === HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) === CH3OH(g) +CO(g) △H>0
则以甲醇制一氧化碳的反应为 反应(填“吸热”、“放热”)。
(4)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4。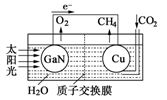
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“氢氧化钠”或“硫酸”)。
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 。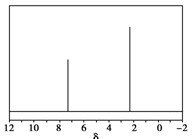
有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。