在一定条件下,二氧化硫和氧气发生如下反应:2SO2+O2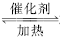 2SO3 ΔH<0。
2SO3 ΔH<0。
(1)写出该反应的化学平衡常数表达式:K=_____________________。
(2)降低温度,该反应K值________,二氧化硫的转化率________,化学反应速率________(以上均填“增大”“减小”或“不变”)。
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3的物质的量变化如右图所示,反应处于平衡状态的时间是______________。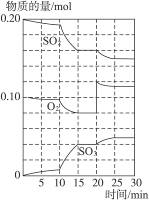
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是______________(用文字表达),10 min~15 min的曲线变化的原因可能是______________(填写编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3的物质的量 |
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2 +、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| a |
加AgNO3溶液 |
有白色沉淀生成 |
| b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
| c |
加足量BaC 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试 回答下列问题:
回答下列问题:
(1)该混合物中一定不存在的离子是。
(2)试写出实验b发生反应的离子方程式。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol·L—1) |
(4)判断混合物中是否存在K+并说明理由?。
(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)整个过程中充当还原剂的是。
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果计量数是1,不用填写):
(3)把KI换成KBr,则CCl4层变为色;继续滴加氯水,CCl4层的颜色没有变化。 Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
已知乙烯能发生以下转化: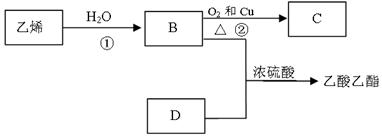
(1)乙烯的结构简式为:
(2)写出反应的化学方程式
①反应类型:
②反应类型:
(1)科学工作者为心脏病人设计的心脏起搏器使用的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧和H+进行工作。回答下列问题:
(1)①正极材料是:,正极反应为:
②负极材料是:,负极反应为:
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:
②乳酸( )与金属钠反应:
)与金属钠反应:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是。