[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:
则100mL滤液中Cu2+的浓度为 mol·L—1,Fe2+的浓度为 mol·L—1
咖啡酸苯乙酯(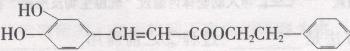 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化: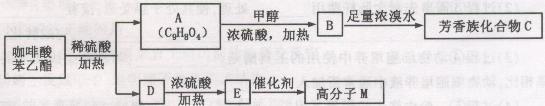
请填写下列空白:
(1)D分子中的官能团是;
(2)高子M的结构简式是;
(3)写出A→B反应的化学方程式;
(4)B→C发生的反应类型有;
(5)A的同分异构体有很多种,其中,同时符合下列条件的同分异构体有种。
①苯环上只有两个取代基②能发生银镜反应
③能与碳酸氢钠溶液反应④能与氯化铁溶液发生显色反应
有机物W(C3H6O3)能与NaHCO3反应,分子中含有四种活动性不同的氢原子,个数比为3∶1∶1∶1。
(1)W的结构简式是 。
(2)W的工业合成路线如下图所示:
已知:Ⅰ.A、B、C、D与W分子中含有相同碳原子数;
Ⅱ.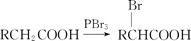
①写出A的结构简式是 ;
②B与新制Cu(OH)2反应的化学方程式是 ;
③D在NaOH水溶液中反应的化学方程式是 ;
④C的同分异构体中,能够与Ag(NH3)2OH溶液反应的有 种。
(3)工业上也可以用下图所示合成路线生产W:
已知:
请在合成路线框图中填入相应有机物的结构简式。
(4)W在一定条件下,反应生成丙交酯(C6H8O4)(含六元环结构),该反应的化学方程式是(有机物写结构简式)。
丙交酯在一定条件下聚合生成聚丙交酯(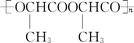 ),聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是
),聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是
。
已知:①R—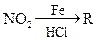 —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图: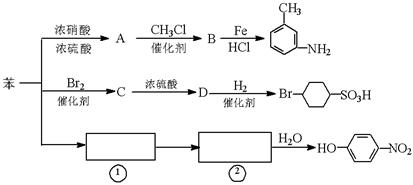
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物 的所有原子(填“是”或“不是”)在同一平面上。
的所有原子(填“是”或“不是”)在同一平面上。
氧化还原反应和离子反应是中学化学中最为重要的两大反应,试根据要求完下列问题:
(1)过量CO2与NaOH溶液反应的化学方程式:;
(2)用过量氨水吸收SO2的离子反应方程式:;
(3)实验室制取AI(OH)3的离子反应方程式:;
胶体与生活息息相关,生活和生产中常用到胶体的性质,请根据所学回答下列问题:
(1)实验室里制取氢氧化铁胶体利用了水解原理,用氯化铁制取氢氧化铁胶体的化学反应方程式为:_______________________________________________________,制备时将饱和的FeCl3溶液滴入沸水中,选用沸水的原因是:______________________________________________________________________。
(2)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,已知血液也是胶体,则氯化铁可止血的原因是__________________________________。
(3)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量。解决方法之一是把这些陶土和水一起搅拌,使微粒直径为10-9 m~10-7 m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集带负电荷的陶土胶粒,阴极聚集带正电荷的氧化铁胶粒,其所利用的胶体性质是___________________________________________。
(4)在肥皂工业的制皂过程中,向皂化反应所得的混合体系中加入NaCI就析出了固体,而后经过简单的制作即得肥皂。此过程称为______________________________。