下表是元素周期表的一部分,A、B、C、D、E、X、Y是一表中给出元素组成的常见单质或化合物。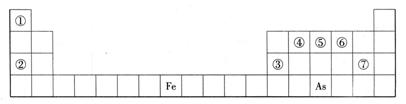
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)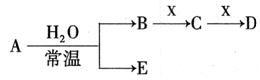
(1)若E为氧化物,则A的化学式为 ,A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 ,B含有的化学键类型为 ,C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t°C时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
II.元素周期是人们研究物质性质的重要工具。
(1)As在周期表中的位置 。
(2)As的原子结构示意图为 ,其氢化物的化学式为 。
(3)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂。As可与Y的溶液反应,生成As最高价含氧酸,该反应的化学方程式为 ,当消耗1mol还原剂时,电子转移了 mol。
二氧化钛是钛的重要化合物,钛白粉(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料.从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:
(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为:.
(2)取少量浸取液,滴加KSCN溶液后呈血红色,说明溶液中存在离子(填写离子符号),检验溶液中还存在Fe2+的方法是(写明步骤、试剂和现象).
(3)浸取液与铁屑反应的离子方程式为;X(晶体)的化学式为.
(4)第③步反应化学方程式.
某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案:
(1)操作①的目的是:;
(2)操作②是否可改为加硝酸钡溶液?为什么?;
(3)进行操作②后,如何判断SO42-已除尽,方法是:;
(4)在操作③中为什么不在加Na2CO3溶液之前先过滤?理由是:;
(5)操作④的目的是:。
1.0mol H2SO4的质量是_______g,约含个分子,含______mol氧原子,能和molNaOH完全反应,该硫酸所含氧元素的质量与mol H3PO4中所含氧元素的质量相同。
含有相同物质的量的二氧化硫和三氧化硫气体分子,其质量之比为,摩尔质量之比为,分子数之比为,其中所含氧原子个数之比为,硫元素质量之比为。
某课外小组同学对不同条件下铁钉的锈蚀进行了实验。一周后观察:
(1)铁钉被腐蚀程度最大的是(填实验序号)。
(2)实验③中主要发生的是______________(填“化学腐蚀”或“电化学腐蚀”)。
(3)写出钢铁生锈的电极反应式(水膜呈中性):
负极______________________________
正极______________________________
总反应式____________________________________
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有(填序号)。
①健身器材刷油漆②自行车钢圈镀铬
③将钢管用导线与镁条连接④将钢管用导线与碳棒连接
我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答以下问题:
如果将刚取样的上述雨水和自来水混和,PH将变。(填“大”、“小”、“不变”)
你认为减少酸雨产生的途径可采用的措施是。
①少用煤作燃料②把工厂烟囱造高③燃烧脱硫
④在已酸化的土壤中加石灰⑤开发新能源
A.①③⑤B.②③④⑤C.①②⑤D.①②③