肉桂醛在食品、医药化工等方面都有应用。
(1)质谱分析肉桂醛分子的相对分子质量为132。其分子中碳元素的质量分数为81.8%,其余为氢和氧。分子中的碳原子数等于氢、氧原子数之和。肉桂醛的分子式是
。
(2)肉桂醛具有下列性质:
请回答:
①肉桂醛是苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原
子,其结构简式是 。(本题均不考虑顺反异构与手性异构)
②Z不能发生的反应类型是 。
| A.取代反应 | B.消去反应 | C.加成反应 | D.加聚反应 |
③Y与乙醇在一定条件下作用得到肉桂酸乙酯,该反应的化学方程式是 。
④Y的同分异构体中,属于酯类目苯环上只有一个取代基的同分异构体有 种。
其中任意一种的结构简式是 。
(3)已知
I.醛与醛能发生反应,原理如下:
II.合成肉桂醛的工业流程如下图所示,其中甲为烃。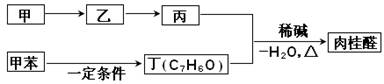
请回答:
①甲的结构简式是 。
②丙和丁生成肉桂醛的化学方程式是 。
③醛和酯也可以发生如“I”的反应。食用香料肉桂酸乙酯通过如下反应合成:
戊的名称是 。
下图中A~J均代表无机物或其水溶液,其中A是红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。已知B可以在高温下与金属活性不如其强的其他金属的氧化物发生置换反应。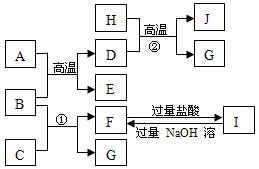
(1)写出下列物质的化学式:
AEI
(2)反应①的离子方程式是E是氧化物(填碱性或酸性或两性)
F与过量盐酸反应的离子方程式是
(3)J与盐酸反应的化学方程式是
反应后的溶液与氯气反应的离子方程式是
有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
(1)A的化学式是
(2)B的化学式是
(3)原白色粉末中一定含有,可能含有,对可能含有的物质,可通过(填实验名称)进一步检验。
古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+NH3·H2O  N2H4 +NaCl+H2O
N2H4 +NaCl+H2O
(1)请配平上述化学方程式。并用单线桥法标出电子转移的方向和数目。
(2)NH3·H2O在上述反应中显示出来的性质是。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是,NaClO发生反应。
(4)若生成 0.2 mol N2H4,则转移的电子为mol。
在浓HNO3中放入铜片:
(1)反应开始时的化学方程为。
(2)若有铜剩余,则反应快要结束时的化学方程式为。
(3)待反应停止时,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是。
(4)若将12.8g铜与一定质量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况),则消耗硝酸的物质的量是,所得气体的平均相对分子质量为。
(5)若将(4)中所得物质配成100mL 溶液,下列操作可能使所配溶液浓度偏小的是_______ ___(填写序号)。
①未洗涤烧杯和玻璃棒②定容摇匀静置后,发现液面低于刻度线后继续加水至凹液面与刻度线相切③配溶液前容量瓶中有少量蒸馏水④定容时俯视容量瓶的刻度线
所得硝酸铜的物质的量浓度为mol/L。
(每空2分,共8分)
(1) 除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2) 除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3) 除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4) 除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。