(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为 。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥ mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性。NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为
用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、 Mg2+、 Ca2+、Cu2+等)制备氯化锌的一种流程如下: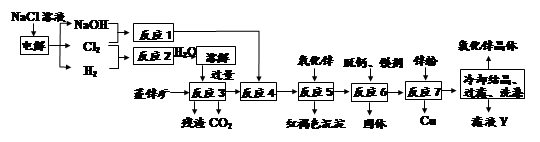
(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)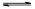 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K=。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为mo1/L 。
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同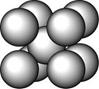

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为, 经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
7.407 |
7735 |
则A原子的原子半径为pm,试解释该晶体原子化热很高的原因。
(已知 ,7.407≈
,7.407≈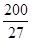 ,1pm=10
,1pm=10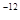 m)
m)
地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如图利用海水得到淡水的方法为。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图。a是电源的极;Ⅰ口排出的是(填“淡水” 或“浓水”)。
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、BaCl2、Na2CO3等),其中HCl的作用主要是。
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为:___________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:________________________。
(5)离子交换树脂法是制备纯水(去离子水) 的主要方法。某阳离子交换树酯的局部结构可写成(如图)。该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经反应得到的。自来水与该离子交换树脂交换作用后显(填“酸性”、“碱性”或“中性”)。
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大。如果硬度过大,饮用后对人体健康与日常生活有一定影响。暂时硬水的硬度是由(填阴离子符号)引起的,经(填操作名称)后可被去掉。永久硬水的硬度可由离子交换法去掉。