原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是 (填元素符号)。
(2)X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a、取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b、另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为 。
②已知1 mol·L-1 100mL B的溶液能与1 mol·L- 1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)=mol·L-1,Kw(25 ℃)Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”)。
(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH=,电离度为。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为。
| 化学式 |
电离平衡常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如下图,回答下列问题:
(1)电极X的材料是,电解质溶液Y是。
(2)银电极为电池的极。
(3)盐桥中阳离子向移动(填“左 ”或“右”)。
(4)外电路中电子是从(填电极材料名称,下同)电极流向电极。
现有可逆反应:mA(g)+nB(g)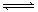 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: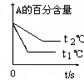
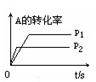
(1)左图中温度t1℃t2℃(填“高于”或“低于”)
(2)该反应的正反应为反应(填“吸热”或“放热”)
(3)右图中压强 p1p2(填“>”、“<”、“=”)
(4)反应式中(m +n)(p +q)(填“>”、“<”、“=”)
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是。
| 第1组 |
第2组 |
第3组 |
| S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。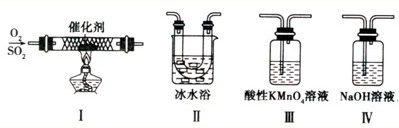
(1)下列实验方案可以用于在实验室制取所需SO2的是。
A.Na2SO3溶液与HNO3B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
| n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
| 序号 |
实验方案 |
实验现象 |
结论 |
| 方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
| 方案② |
往第二份试液中加入 |
SO2与Fe3+反应生成了Fe2+ |
|
| 方案③ |
往第二份试液中加入 |
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理,原因。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是。
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(2)下图是某市污水处理的工艺流程示意图: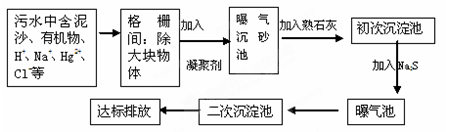
① 下列物质中不可以作为混凝剂(沉降剂)使用的是(填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是(填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯g。