可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。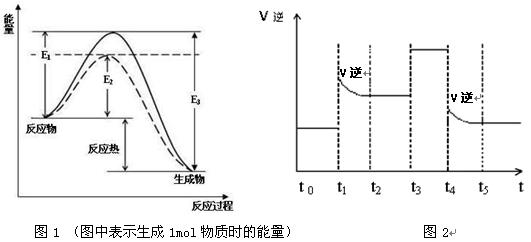
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2)图1中虚线部分是通过改变化学反应中的 条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
不同金属离子在溶液中完全沉淀时,溶液的pH不同。
| 溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH |
≥3.7 |
≥6.4 |
≥4.4 |
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。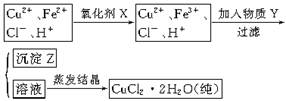
⑴下列氧化剂中最适合作氧化剂X的是(填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
⑵物质Y的化学式是;
⑶写出沉淀Z在水中的沉淀溶解平衡方程式:。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)写出泡沫灭火器反应原理(用离子方程式表示):。
(3)医院里用HgCl2的稀溶液作手术刀的消毒剂。HgCl2熔融时不导电,熔点低。HgS难溶于水和稀的强酸却易溶于饱和的NaCl溶液中。试推测HgCl2是化合物(填“离子”或“共价”),是电解质(填“强”或“弱”)。
(4)水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是。
下列各组物质中括号中为杂质,请填写除去杂质所用的试剂及反应的离子方程式:
(1).NaHCO3溶液(Na2CO3),用__________试剂,离子方程式___________。
(2).CO2(HCl),用___________ 试剂,离子方程式。
某溶液中含有OH-、CO32-、SO42-三种阴离子,如果只取一次溶液分别将三种离子检验出来,那么:
(1)先检验,加入试剂(或溶液)。
(2)再检验,加入试剂(或溶液)。
(3)最后检验,加入试剂(或溶液)。
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,是氧化剂;元素被氧化;是氧化产物;被还原的HNO3与参加反应的HNO3物质的量之比是。