钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。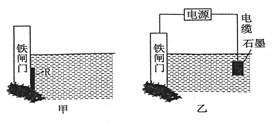
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________
(2)为了降低某铁闸门被腐蚀的速率,可以采用上述图甲所示的方案,其中焊接在铁闸门上的固定材料R可以采用____(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)上图乙所示的方案也可以降抵铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_______极。
Ⅰ.下列是用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 mL 0.5 mol·L-1的稀硫酸的实验操作,请按要求填空:
(1) 计算所需浓硫酸的体积为________mL(保留一位小数);
(2) 如果实验室有10 mL、20 mL、50 mL的量筒,应选________规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”)__________;
(3) 将量取的浓硫酸沿烧杯内壁慢慢注入盛有约少量水的烧杯里,并不断搅拌,搅拌的目的是______;
(4) 将冷却至室温的上述溶液沿玻璃棒注入________中,并用50 mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;在转移过程中有少量液体洒在桌子上,则最终所配浓度将(填“偏高”、“偏低”或“无影响”) 。
(5) 加水至距刻度线1~2 cm处,改用________加水至刻度线,使溶液的凹液面恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液。
II.)就有关物质的分离回答下面的问题,有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9[ |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是
(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话说明维生素C在这一反应中起的作用________。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,黑火药在发生爆炸时,发生如下的反应:S+2KNO3+3C= K2S + N2↑+3CO2↑;其中被还原的元素是 ,被氧化的元素是 ;氧化剂是 ,还原剂是 ;氧化产物是 ,还原产物是 (填元素符号或物质的化学式)。
下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题: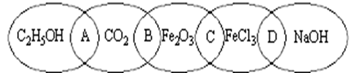
(1)两种物质都是电解质的是_______(填分类标准代号,下同),两种物质都是氧化物的是________。
(2)分类标准代号A表示______________(多项选择)
a.两物质都是非电解质 b.两物质都是有机物
C.两物质都是含碳化合物 d.两物质都是氧化物
(3)上述五种物质中的某相邻两种物质间能发生反应且有离子反应,写出该反应的离子方程式为: ____________________ _____________________。
(4)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为_____________。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的由线如图所示。请回答: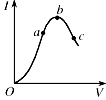
(1)“O”点导电能力为O的理由是 。
(2)a,b,c三点溶液中 c(H+)由小到大的顺序为 。
(3)a,b,c三点中电离程度最大的是 。
(4)使C点溶液中C(CH3COO-)增大,溶液c(H+)减小,可采取的
措施是:① ② ③ (至少填两个空)
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。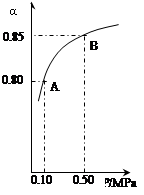
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g)△H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中,放出的热量为______kJ。