A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
请回答下列问题:
(1)B、D在周期表中同处在_____族,D的原子结构示意图是 ,下列可以验证B与D两元素原子得电子能力强弱的实验事实是 (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ;
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为 ;
(4)D元素的气态氢化物和其低价氧化物所发生的反应中氧化产物与还原产物的物质的量之比为 。
已知2A2(g) + B2(g) 2C(g)
2C(g) 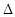 H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)ab(填“>”“=”或“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达到平衡后,吸收热量c kJ,C的浓度w mol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:(用等式表示)。
(4)能说明该反应已经达到平衡的状态的是。
a.ν(C)=2ν(B2)b.容器内压强保持不变
c.ν(逆)(A2)=ν(正)(B2) d.容器内的密度保持不变
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题:
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式:。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是。
(4)欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式)。
(5)装置丁中的现象是。
依据事实,写出下列反应的热化学反应方程式。
(1)在25℃、101kPa下,1g甲醇完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为。
(2)若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量,则表示该反应的热化学方程式为。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,则表示该反应的热化学方程式为 _________________________________________________。
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为。
物质A~F有如图所示的转化关系。已知A、B、C均为单质,且室温下A为用途广泛的金属、B为黄绿色气体、C为密度最小的无色气体,E为气体,E溶液呈强酸性且无色,D溶液呈黄色。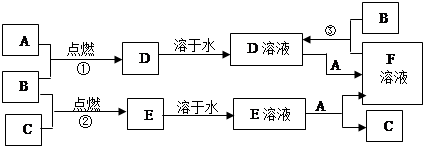
请回答下列问题:
(1)写出下列物质的化学式:A、B 、C 、D 、E 、F 。
(2)写出反应②的化学方程式:。
(3)写出反应③的离子方程式:。
写出实验室制取NH3的化学反应方程式为_______;常用干燥NH3 ;收集时应用法收集;检验NH3是否已充满试管的方法是。