电解原理在化学工业中有广泛应用。右图表示一个电解池,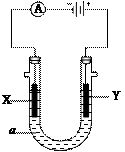
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
②电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl2 2L(填“>”“<”“=”),
原因是 。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是____ __(写元素名称),其电极反应式 。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
已知: I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O,加入CuO,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O。
(2)在空气中直接加热CuCl2·2H2O得不到纯的无水CuCl2,原因是 (用化学方程式表示)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I- 2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
2CuI↓+I2)。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
① 可选用 作滴定指示剂,滴定终点的现象是 。
② 该试样中CuCl2·2H2O的质量分数为 。
已知t ℃时,0.01 mol·L-1NaOH溶液的pH="11,0.1" mol·L-1的HA溶液中c(H+)/c(OH-)=109。请回答下列问题:
(1) 该温度下,水的离子积KW= ,HA是 (填“强”或“弱”) 酸。
(2) 该温度下,将pH之和为13的NaOH溶液和HA溶液等体积混合后,所得溶液呈 (填“酸”、“碱”或“中”) 性。
(3) 在室温下,用蒸馏水稀释0.01 mol·L-1 HA溶液时,下列各项呈减小趋势的是 。
A.c(H+)/c(A-)
B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积
D.溶液中c(A-)·c(HA)的值
E.水的电离程度
(4) 室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
①图中表示HA溶液pH变化曲线的是 (填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1 m2(填“>”、“<”或“=”)。
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB- H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1) Na2B溶液显__________(填“酸性”“中性”或“碱性”)。理由是__________(用离子方程式表示)。
(2) 在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是____________。
A. c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
B. c(OH-)=c(H+)+c(HB-)
C. c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D. c(Na+)=2c(B2-)+2c(HB-)
(3) 0. 1mol•L-1NaHB溶液中各种离子浓度由大到小的顺序是____________。
(1)常温下,0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则
①混合溶液中由水电离出的c(H+) (填“>”、“<” 或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)- c(M+)= mol·L-1;c(H+)- c(MOH)= mol·L-1。
(2) 常温下若将0.2 mol·L-1MOH溶液与0.1 mol·L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度 (填“>”、“<”或“="”)" MCl的水解程度。
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1) 若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”)
(2) 若溶液由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为 ;pH由大到小的顺序为 。(填序号)
(3) 若溶液由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________。
A、大于 B、等于C、小于D、均有可能
(4) 已知Ksp(BaA)= 1.8×10-10,向(1)的混合溶液中加入10mL 1 mol•L-1BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol•L-1。