电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图18所示:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.N2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是① ;
② 。
。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是 。
。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
下表列出了3种燃煤烟气脱硫方法的原理。
(1)方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为: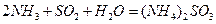

能提高燃煤烟气中 去除率的措施有__________(填字母)。
去除率的措施有__________(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D . 通入空气使
. 通入空气使 转化为
转化为
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2)方法Ⅱ重要发生了下列反应:
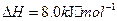






 与
与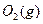 反应生成
反应生成 的热化学方程式为
的热化学方程式为 。
。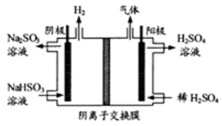
(3)方法Ⅲ中用惰性电极电解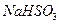 溶液的装置如上图所示。阳极区放出气体的成分为。(填化学式)
溶液的装置如上图所示。阳极区放出气体的成分为。(填化学式)
以水氯镁石(主要成分为 )为原料生产碱式碳酸镁的主要流程如下:
)为原料生产碱式碳酸镁的主要流程如下:
(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的 ,若溶液中
,若溶液中 ,则溶液中
,则溶液中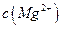 = 。
= 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 。
。
(3)高温煅烧碱式碳酸镁得到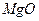 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下 0.896L,通过计算确定碱式碳酸镁的化学式。
0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有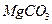 ,则产品中镁的质量分数▲ (填 “升高”、“降低”或“不变”)。
,则产品中镁的质量分数▲ (填 “升高”、“降低”或“不变”)。
钡盐行业生产中排出大量的钡泥[主要含有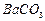 、
、 、
、 、
、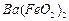 等。某主要生产
等。某主要生产 、
、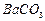 、
、 的化工厂利用钡泥制取
的化工厂利用钡泥制取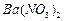 ,其部分工艺流程如下:
,其部分工艺流程如下: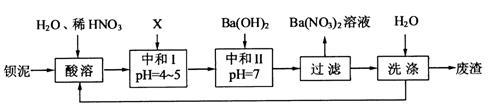
(1)酸溶后溶液中 ,
,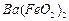 与
与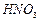 的反应化学方程式为 。
的反应化学方程式为 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。

上图中
均为有机化合物,根据图中的信息,回答下列问题:
(1)环状化合物
的相对分子质量为82,其中含碳87.80%,含氢12.20%。
的一氯代物仅有一种,
的结构简式为;
(2)
是
的一种同分异构体,
能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则
的结构简式为;
(3)由
生成
的反应类型是,由
生成
的反应类型是;
(4)
的分子式为
,0.146g
需用
溶液完全中和,
是一种高分子化合物。则由
转化为
的化学方程式为;
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应
则由
和
反应生成F的化学方程式为;
(6)
中含有的官能团是,
中含有的官能团是。

如图是一个用铂丝作电极,电解稀的
溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的
变色范围:6.8~8.0,酸色-红色,减色-黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号);
①
管溶液由红变黄;②
管溶液由红变黄;
③
管溶液不变色;④
管溶液不变色;
(2)写出
管中发生反应的反应式:;
(3)写出
管中发生反应的反应式:;
(4)检验
管中气体的方法是;
(5)检验
管中气体的方法是;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是。