制取碘盐的流程如下:
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是 ▲ 。
(2)过滤时,用到的玻璃仪器有: ▲ 、 ▲ 、 ▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为: ▲ mg/Kg(保留一位小数),是否是合格产品 ▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是 ▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式: ▲ 或 ▲ 。
化学史上很多重要物质的发现背后都有科学家们的兴趣、坚持、创新与传承。例如氨的发现史,阅读下文并填空。
1727年,英国牧师、化学家哈尔斯用氯化铵与熟石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出;
(1)哈尔斯制氨气发生的反应方程式为,水吸入曲颈瓶的原理与实验相同。氨的电子式为;
1774年英国化学家普利斯特里重作这个实验,采用汞代替水来密闭曲颈瓶,即排汞取气法,制得了碱空气(氨)。他还研究了氨的性质,他发现;
(2)氨可以在纯氧中燃烧,已知该反应为一个置换反应,反应方程式为,预期该反应在生产上(填有或无)实际用途。
(3)在氨气中通以电火花时,气体体积在相同条件下增加很多,该反应的化学方程式是,据此证实了氨是氮和氢的化合物。其后戴维等化学家继续研究,进一步证实了氨的组成。
用锌棒、石墨和CuCl2溶液组成的原电池,锌棒上发生反应(填“氧化”或“还原”),该电极反应式为______________________;石墨棒上观察到的现象为_____________________。该装置在工作过程中,电子从锌棒经过(填“导线”或“溶液”)流向石墨棒。
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
||
| Z |
W |
M |
请按要求回答下列问题:
(1)X元素名称,W的离子结构示意图;
(2)元素Z位于周期表中的位置是;
(3)元素Z可以形成多种单质,请任意写出一种常见单质的名称;
(4)Y的最高价氧化物的化学式为____ _;M的最高价氧化物水化物名称为_______;
(5)Z、W、M三种元素中,原子半径最大的是(填元素符号);这三者与氢元素形成的化合物中,最稳定的是(填:氢化物的化学式),它的电子式为;
(6)X与M可形成XM4型化合物,是一种常见的溶剂,其中的化学键类型是(填:“离子键”或“共价键”)。
(7)W的氧化物有两种A和B,已知在某一定条件下,A和B能同时相互转化。则在该条件下A完全转化为B(填:“能”或“不能”)
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如下图所示,其中A、B、C都为气体。则该反应的化学方程式为。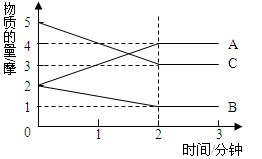
下列递变规律不正确的是
| A.Na.Mg、Al还原性依次减弱 |
| B.I2、Br2、Cl2氧化性依次增强 |
| C.原子半径:F<Mg<K |
| D.稳定性:PH3>H2S> HCl |