恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气) C(气)。
C(气)。
I(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。平衡时,B的物质的量____________(选填一个编号)
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)
(甲)a<b (乙)a>b (丙)a="b " (丁)不能比较a和b的大小
作出此判断的理由是_______________________________。
在①CH2=CH2②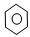 ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是 ;(请填物质的序号,下同。);
(2)能使Br2的CCl4溶液褪色的是 ;
(3)既能发生取代反应又能发生加成反应的是 ;
(4)能与Na2CO3溶液反应的是 ;
(5)能发生酯化反应的是 ;
现有A、B、C三种烃,其球棍模型如下图: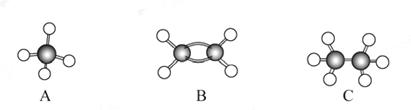
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_____(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是_____;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120 ℃、1.01×105Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是_____。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。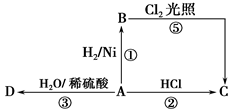
据图回答下列问题:
(1)写出A、C、D的结构简式:A________, C________, D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________________________反应类型为____________。
②_______________________________________________
下列物质中互为同分异构体的有 ,互为同素异形体的有 ,属于同位素的有 ,属于同一种物质的有 。(填序号)
①液氯 ②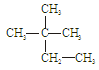 ③白磷 ④18O ⑤
③白磷 ④18O ⑤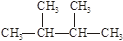
⑥红磷⑦16O⑧氯气
有机高分子化合物在日常生活中有非常广泛的应用。一种广泛应用于电器、工业交通的工程塑料DAP的结构简式是: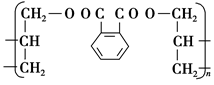
试回答:
(1)生产DAP工程塑料的单体的结构简式是__________________________。
(2)DAP工程塑料的单体,可以由两种有机物通过一步反应合成出来,则这两种有机物的结构简式是____________________和_______________。