Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)
Ⅱ.某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。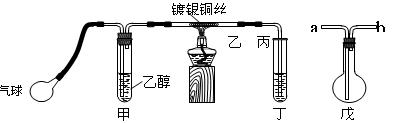
填写下列空白:
(1)甲装置常常浸在70~80℃
的水浴中,目的是 。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。 乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接 、_ _接丙。
氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下: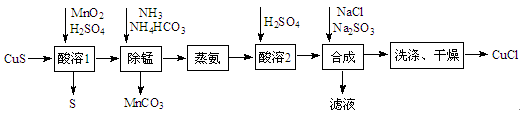
(1)酸溶1步骤中加入MnO2的作用是。
(2)除锰步骤Mn2+转化为MnCO3沉淀,该反应的离子方程式为。溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。
(3)蒸氨步骤会得到CuO固体,该步骤在减压条件下进行的原因是。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生SO2气体,除可能与酸溶时硫酸过量有关,还可能的原因是。
(5)有工艺将合成步骤的NaCl与Na2SO3换为NH4Cl和(NH4)2SO3,则可获得一种可作为氮肥的副产品,其化学式为。
(6)洗涤步骤先用洗,再用无水乙醇洗涤。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
存在Fe3+ |
|
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴(填序号)溶液,振荡 |
存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是。
(3)经小组讨论并验证该无色气体为O2,其操作方法是。
(4)【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为。
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为。
某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如右图所示。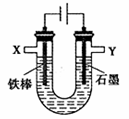
实验一:电解饱和食盐水。
(1)简述配制饱和食盐水的操作:
(2)电解饱和食盐水的离子方程式为
实验二:电解不饱和食盐水及产物分析。
相同条件下,电解1 mol·L一1NaCl溶液并收集两极产生的气体。在X处收集到V1mL气体,同时,在Y处收集到V2mL气体,停止电解。结果发现V2<V1,且与电解饱和食盐水相比,Y处收集到的气体颜色明显较浅。经讨论分析,导致上述现象的原因有:
i.有部分C12溶解于NaCl溶液中;ii.有02生成。
(3)设计实验证明有部分C12溶解于NaCl溶液中。实验方案为。
(4)证明有O2生成并测定O2的体积。
按如图所示装置进行实验。通过注射器缓缓地将在Y处收集到的V2mL气体全部推入装置A(盛有足量试剂)中,最终,量气管中收集到V3mL气体(设 均在相同条件下测得)。
均在相同条件下测得)。
①装置A的作用是。
②本实验中,观察到的现象,说明石墨电极上有02生成。
③实验中是否需要预先除净装置中的空气?(填“是”或“否”)。
(5)实验二中,在石墨电极上生成Cl2的总体积为mL(用代数式表示)。
实验反思:
(6)由以上实验推知,欲通过电解食盐水持续地获得较纯净的氯气,电解时应控制的条件:
①;②。要进一步证明该推论,还需进行电解不同浓度食盐水的平行实验。
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂。它易溶于水,难溶于酒精,受热、遇酸易分解。工业上可用硫化碱法制备,反应原理:2Na2S + Na2CO3 + 4SO2=3Na2S2O3 + CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
(1)b中反应的离子方程式为_________________________,c中试剂为__________。
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是____________。
(3)控制b中的溶液的pH接近7,停止通入SO2。若未控制好,pH<7,会影响产率,原因是(用离子方程式表示)。
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为________。
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)。
(6)实验中要控制SO2生成速率,可采取的措施有________________(写出一条)。
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是,(用百分数表示,保留1位小数)间接碘量法滴定过程中可能造成实验结果偏低的是。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: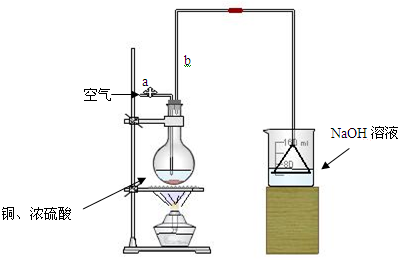
(1)首先根据上图所示,组装实验装置,并在加入试剂前先进行操作。
(2)烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
(3)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的(填仪器名称)起到了确保硫酸体积保持不变的作用。
(4)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行、、后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是。
(5)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析:(填“需要”或“不需要”)加入双氧水,原因:。