硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.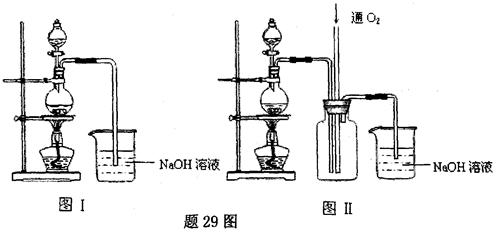
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾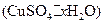 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 |
加热后质量 |
|
| m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
| 5.4g |
7.9g |
6.8g |
①为完成测定,题29图Ⅲ中还缺少的仪器名称是 。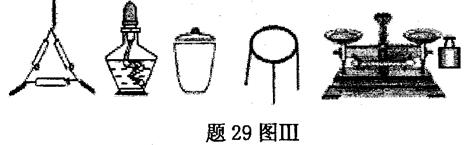
②判断样品已恒重的方法是 。
③测定所得胆矾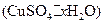 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与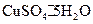 相比
相比 ) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
有一固体样品,其中只含有Na2 CO3•10H2O和NaH
CO3•10H2O和NaH CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ ……。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用 的装置连接好后,最后一个装置的作用是_______________________________。
的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO2的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得agCO2,则m g样品中所含。Na2CO3的质量分数为________________________________。(用含m、a的代数式表示)
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。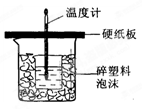
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是;(由图可知该装置有两处不妥之处:(1)。(2 )。
(2)烧杯间填满碎塑料泡沫的作用是________。
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___。(填“偏大”、“偏小’、“无影响”)。
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃.溶液混合后的最高温度为28.6℃.试经过计算写出表示该反应中和热的热化学方程式:________
(混合溶液的比热容c=4.18J/(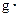 ℃),盐酸和NaOH溶液的密度认为都是1
℃),盐酸和NaOH溶液的密度认为都是1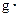
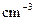 )
)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大”、“偏小”、“无影响”)。
(10分)欲配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题.
(1)计算:需要NaOH固体的质量为______________.
(2)某学生用托盘天平称量小烧杯的质量(烧杯中盛NaOH),称量前把游码放在标尺的零刻度,天平静止时发 现指针在分度盘的偏右位置,此时左边的托盘将____________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为____________.假定最终称量小烧杯的质量为________(填“32.6 g”或“32.61 g”).
现指针在分度盘的偏右位置,此时左边的托盘将____________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为____________.假定最终称量小烧杯的质量为________(填“32.6 g”或“32.61 g”).
(3)在标尺(图)上画出游码位置(画“△”表示).
实验室制取少量溴乙烷的装置如右图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为
和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为
(选填编号)。
a.天平 b.量筒 c.容量瓶 d.烧杯
(2)写出加热时烧瓶中发生的主要反应的两个化学方程式、。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。
生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。
(4)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 (选填编号)。
(选填编号)。
a.蒸馏 b.氢 氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(5)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因是。
(14分)如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
(1)要将C装置接入B和D之间,正确的接法是:a→ → →d。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为______________________。
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_____________________________________________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 ,B的作用是______________________。
(4)用量筒量取20 mL E中溶液,倒入已检查完的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞(如图),振荡,静置于铁架台上,等分层后取上层液和下层液,呈黄绿色的是 (填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是 (填“上层液”或“下层液”)。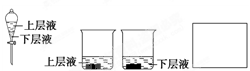
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由______________________________,并在方框中画出改进后的装置图。