高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为  。
。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO3 5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 mL |
0.02 |
24.01 |
| 2 |
25.00 mL |
0.70 |
24.71 |
| 3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
| A.未用标准浓度的酸性KMnO4溶液润洗滴定管 |
| B.滴定前锥形瓶未干燥 |
| C.滴定前滴定管尖嘴部分有气泡 |
| D.观察读数时,滴定前仰视,滴定后俯视 |
④用上述实验数据,计算Na2SO3的纯度为 。
下图是一个化学过程的示意图。已知甲池的总反应式为: 2CH3OH+3O2+4KOH2K2CO3+6H2O填写下列空白:
(1)请写出甲、乙两池的名称。甲电池是,乙池是。
(2)甲池中通入CH3OH的电极名称是,电极反应方程式为;乙池中B(石墨)电极的名称是。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
下图为以惰性电极进行电解。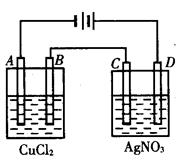
(1)写出A、B、C、D各电极上的电极方程式:
A_________________________B_______________________
C_________________________D_______________________
(2)在A、B、C、D各电极上析出生成物的物质的量比
常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是(填序号)
(2)上述溶液中,既能与NaOH溶液反应,又能与H2SO4溶液反应的溶液中,离子浓度大小的关系
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值(“增大”、“减小”或“不变” )
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积④的体积(“大于”、“小于”或“等于” )
(5)取10mL的③溶液,加水稀释到500mL,则此溶液中由水电离出的c(H+)=________mol/L
请完成下列各空:
(1) pH= a的CH3COOH溶液稀释100倍后所得溶液pHa +2(填“>”或“<” 下同)
(2)0.01 mol·L-1CH3COOH溶液的pH2
(3)0.1 mol·L-1CH3COONa溶液的pH7
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。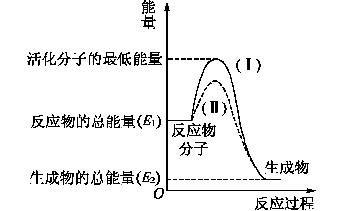
(1)图中所示的反应是__________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要” )加热,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因___________。