在工业上烯烃可以合成多种有机材料。
(1)某同学设计了由乙烯合成Y的3条路线(I、II、III)如下图所示。
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、 “II”或“III”) 。
② X的结构简式是 。
(2)已知Q为乙烯的同系物,以Q和X为原料合成M的方法如下: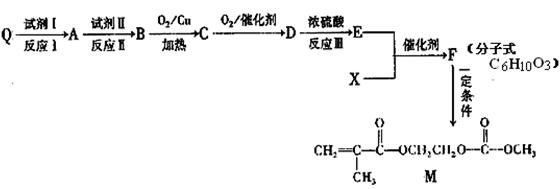
请回答下列问题:
①Q的名称是
②E中含有官能团的名称是 ,F的结构简式是 .
③写出M与足量氢氧化钠溶液反应的化学方程式
④已知: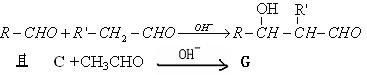
G的同分异构体有多种,写出符合下列条件的G的所有同分异构体
a.与钠反应放出氢气 b.在酸性条件下水解为N和乙醇 c. N中含有支链
将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) + CO( g) 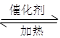 CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
| 实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
1.2 mol |
5 min |
| 2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.8 mol |
3 min |
| 3 |
900℃ |
a |
b |
c |
d |
t |
(1)①由以上数据,实验1中以v( CO2) 表示的反应速率为__________。
②该反应在650℃时平衡常数数值为__________,该反应的逆反应为__________ (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t <3min,则a、b 应满足的关系是__________。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的情况:
①图1中时刻t2发生改变的条件可能是__________ (写2条)
②图2中时刻t2发生改变的条件可能是__________ (写2条)
(3)在850℃时,其平衡常数K = 1,850℃时在该容器中同时充人1.0moICO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向__________(填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为__________。
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。

(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
a.v消耗(CH3OH)="2" v消耗(H2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
已知丁烷燃烧热△H=" -akJ" /mol ,写出丁烷燃烧热的热化学方程式___ ___________;完全燃烧一定量的丁烷,放出的热量为Q,已知为了完全吸收生成的CO2,消耗掉4mol/L NaOH溶液50mL ,则1mol丁烷完全燃烧放出的热量Q1的范围为______________________________。
SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+ 3F2(g)= SF6的反应热△H为______________________________。
(1)已知在K2Cr2O7的溶液中存在如下平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
2CrO42-(黄色)+2H+,向5mL0.1mol/L K2Cr2O7溶液中滴加3-10滴浓H2SO4,观察到的现象为__________;在此基础上再滴加5-10滴6mol/LNaOH溶液,溶液颜色变化为__________。
(2)已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是__________(填序号)。
①生成物的产量一定增加
②生成物的体积分数一定增加
③反应物的浓度一定降低
④反应物的转化率一定增加
⑤正反应速率一定大于逆反应速率