(10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向 ( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生 反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是: ,通过该原电池装置实现了从化学能向 的转化。
Zn-Cu-H2SO4原电池的负极材料是是,正极反应式是,发生反应(填反应类型),总反应式为___________________________________。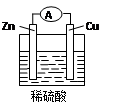
在反应H2 + Cl2=2HCl中,已知H-H键能为436kJ/mol,Cl-Cl键能为243kJ/mol,H-Cl键能为432kJ/mol。
判断该反应是放热还是吸热。
计算生成1mol HCl时反应的能量变化。
(1)核素:人们把具有一定数目和一定数目的一种原子称为核素。
同位素:相同而不同的同一元素的不同原子互称为同位素。
(2)已知化学能与其他形式的能量能够相互转化:
二次电池充电是将转化为;
植物光合作用是将转化为。
(6分)(3)写出下列物质的电子式:
N2 H2O CaCl2
炭火炉内的炭燃烧至炽热时,在往炉膛底的热炭上喷洒少量水的瞬间,炉火更旺,这是因为。
如果烧去“同量的炭,喷洒过水和没有洒过水的炭火炉相比,放出的总能量(填“相同”或“不相同”),原因是 。
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出14种元素的X的数值:
| 元素 |
H |
Li |
Be |
B |
C |
O |
F |
| X的数值 |
2.20 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
| X的数值 |
0.93 |
1.31 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系___________________________;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系___________________________________。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于_____原子(填元素符号)。
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______________。
(5)上表中元素形成的AB型化合物中,离子性最强的是________。