已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为_____________(填序号)。
(2)25℃时,将20mL 0.1mol·L-1 CH3COOH溶液和20mL 0.1mol·L-1 HSCN溶液分别与20mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:______________________。
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Chrisie首次用化学方法制得了F2,他提出的三步反应如下:
①KMnO4+KF+H2O2+HF―→K2MnF6+______+H2O
②SbCl5+HF===SbF5+5HCl
③2K2MnF6+4SbF5===4KSbF6+2MnF3+F2↑
请根据以上信息回答下列问题:
(1)反应①中空格上应填物质的化学式为__________________。
(2)反应②是否为氧化还原反应________(选填“是”、“否”或“无法确定”)。
(3)反应③中的氧化剂为________,被氧化的元素为________。
(4)每生成1mol F2,消耗KMnO4的物质的量为。
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______________。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_______________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为____________,其存在的最高温度是________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为______________________________________________________
(1)23.75g某二价金属的氯化物(MCl2)中含有3.01×1023Cl-,则MCl2的摩尔质量是________,MCl2的相对分子质量是________,M的相对原子质量是________。
(2)2 mol 尿素[CO(NH2)2]所含氧原子跟________ g H2O所含氧原子个数相等。
(3)标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是________。
食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯(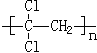 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由_______(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由_______(写结构简式)发生加聚反应生成的.
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH]含量很低.下列关于亚油酸的说法中,正确的是_________ .
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液退色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:____ __ .
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是______ ___ .
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:______ ___ .
(6)下列有关实验的叙述,正确的是_____(填序号)
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
(12分)推断下列化合物的化学式:
(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是__________;若XY2是共价化合物,其化学式是__________。
(2)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为____。
(3)1 mol某共价化合物,含有三种短周期元素的原子各1 mol,且三种元素分别属于不同的周期,其质子总数为26 mol,其中一种元素的最外层有7个电子,则该物质的化学式为__________。
(4)某非金属X的最低负价为-2,它的最高价氧化物对应的水化物为强酸,则这种酸的化学式是__________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素的化合价为+1,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是__________。